
【题目】化学反应A2(g) + B2(g)=2AB(g) 的能量变化如图所示,下列叙述中正确的是( )
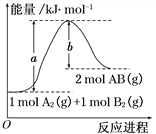
A.每生成2mol AB(g) 共吸收b kJ热量
B.该反应热ΔH = +(a-b) kJ·mol-1
C.反应物的总能量大于生成物的总能量
D.断裂1 mol A—A键,放出a kJ能量
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O,M=180g/mol)呈淡黄色,可用于晒制蓝图。某实验小组对其进行了一系列探究。
Ⅰ.纯净草酸亚铁晶体热分解产物的探究
(1)气体产物成分的探究。小组成员采用如图装置进行实验:
A. B.
B. C.
C.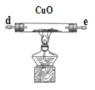 D.
D. E.
E.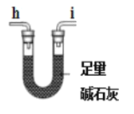
①按照气流从左到右的方向,上述装置的接口顺序为a→g→f→___→尾气处理装置(仪器可重复使用)。
②检查装置气密性后,先通入一段时间N2,其目的为__。
③实验证明了气体产物中含有CO,依据的实验现象为__。
④结束实验时先熄灭A、C处的酒精灯再停止通入N2,其目的是__。
(2)小组成员设计实验证明了A中分解后的固体成分为FeO,则草酸亚铁晶体分解的化学方程式为__。
(3)晒制蓝图时,草酸亚铁晶体是感光剂,会失去结晶水转化为FeC2O4,现以K3[Fe(CN)6]溶液为显色剂,该显色反应的化学方程式为__。
Ⅱ.草酸亚铁晶体样品纯度的测定
工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:
步骤1:称取mg草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液;
步骤2:取上述溶液25.00mL,用cmol·L-1KMnO4标准液滴定至终点,消耗标准液V1mL;
步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L-1KMnO4标准溶液滴定至终点,消耗标准液V2mL。
(4)步骤2中滴定终点的现象为__;步骤3中加入锌粉的目的为___。
(5)若步骤![]() 配制溶液时部分Fe2+被氧化变质,则测定结果将__(填“偏高”、“偏低”或“不变”)
配制溶液时部分Fe2+被氧化变质,则测定结果将__(填“偏高”、“偏低”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸是中学化学常用的试剂,以下两个实验均和盐酸有关。
I.用密度为1.25 g·mL-1,质量分数36.5%的浓盐酸配制500 mL 0.20 mol·L-1盐酸溶液,请回答下列问题:
(1)浓盐酸的物质的量浓度为____________。
(2)配制500 mL 0.20 mol·L-1盐酸需要用量筒量取上述浓盐酸_______mL。
(3)对配制的盐酸测定,发现物质的量浓度小于0.2 mol·L-1,引起该误差的操作___(填序号)
A.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
B.用量筒量取浓盐酸时,仰视刻度线量取浓盐酸
C.定容时,仰视容量瓶刻度线进行定容
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,又滴加水至刻度处
Ⅱ.某学生设计如下图所示的实验装置,利用浓盐酸与高锰酸钾反应产生的氯气与熟石灰反应制取少量漂白粉,并探究氯、溴、碘的相关性质。请回答下列问题:

(4)A装置名称为________。
(5)漂白粉将在C装置的U形管中产生,写出生成漂白粉的化学方程式_______________。
(6)E装置中装有KI与CCl4混合液,向D中缓缓通入一定量氯气后,打开D装置中活塞,将D中少量溶液滴加入E装置中,振荡,观察到下层呈紫红色,由此得出结论:Br2置换出了I2,有同学对该结论提出异议,可能的理由是__________________________。
(7)F装置的作用是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题。

(1)从实验装置上看,图中有一处仪器未画出的是_____________________。
(2)在其他操作正确的前提下,提高中和热测定准确性的关键是____________。大烧杯上如不盖硬纸板,求得的中和热数值___(填“偏大”“偏小”或“无影响”)
(3)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将______(填“偏大”、“偏小”、“不变”);原因是___________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的生成1 mol液态水时放出热量的数值_______________(填“偏大”、“偏小”、“不变”)。
(5)实验中NaOH过量的目的是___________。
(6)若某同学利用上述装置做实验有些操作不规范,造成测得中和热偏小,请分析可能原因(________)。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.用量筒中的氢氧化钠溶液倒入小烧杯时动作缓慢
C.在量取盐酸时仰视读书
D.大烧杯的盖板中间小孔太大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复旦大学王永刚的研究团队制得一种柔性水系锌电池,该可充电电池以锌盐溶液作为电解液,其原理如图所示。下列说法不正确的是( )
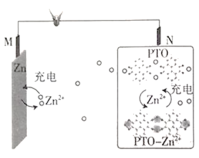


A.放电时,N极发生还原反应
B.充电时,Zn2+向M极移动
C.充电时,N极的电极反应式为2PTO+8e-+4Zn2+==PTO-Zn2+
D.放电时,每生成1molPTO-Zn2+,M极溶解![]() 的质量为260g
的质量为260g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;
②FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③实验②生成的溶液滴在KI试纸上,试纸变蓝
下列判断正确的是( )
A.上述实验证明氧化性:![]() >Cl2>Fe3+>I2
>Cl2>Fe3+>I2
B.上述实验中共有两个氧化还原反应
C.实验①生成的气体不能使湿润的KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱。有关反应的化学方程式为:NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3↓+NH4Cl;2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
回答下列问题:
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是___(填字母标号)。
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验。
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如图所示(图中夹持、固定用的仪器未画出)。

试回答下列有关问题:
(Ⅰ)乙装置中的试剂是___;
(Ⅱ)丁装置中稀硫酸的作用是___;
(Ⅲ)实验结束后,分离出NaHCO3晶体的操作是___(填分离操作的名称)。
②另一位同学用图中戊装置(其它装置未画出)进行实验。
(Ⅰ)实验时,须先从___管通入___气体,再从___管中通入___气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是___;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+3H2O
2N2(g)+3H2O![]()
在恒容的密闭容器中,下列有关说法正确的是
A. 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B. 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C. 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡
D. 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用。
(1)该同学用到的玻璃仪器除了烧杯、量筒、试剂瓶,还需要_________________。
(2)其操作步骤如下图所示,则如图操作应在下图中的_______(填选项字母)之间。
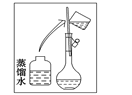

A.②与③ B.①与② C.④与⑤
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小__________(填字母)
a | b | c | d | e | |
砝码大小/g | 100 | 50 | 20 | 10 | 5 |
并在下图中选出能正确表示游码位置的选项________(填字母)。
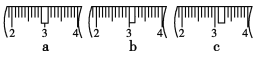
(4)下列操作对所配溶液的浓度大小有何影响?
① 转移完溶液后未洗涤玻璃棒和烧杯,浓度会_______(填“偏大”、“偏小”或“无影响”,下同)。
② 容量瓶中原来有少量蒸馏水,浓度会__________。
③ 以480mL溶液体积计算所需NaOH的质量_________。
④ 未冷却到室温就注入容量瓶定容_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com