
毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
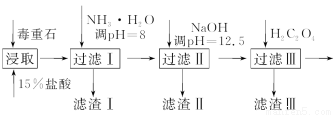
(1)毒重石用盐酸浸取前需充分研磨,目的是 ;
直接蒸干BaCl2溶液 (填“能”或“不能”)得到BaCl2·2H2O晶体。
(2)
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
加入NH3·H2O调节pH=8可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是_____________________________。
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+===Cr2O72-+H2O Ba2++CrO42-===BaCrO4↓
步骤Ⅰ 移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ 相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。BaCl2溶液的浓度为________mol·L-1。
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源:2016届河北省高三上学期第三次月考化学试卷(解析版) 题型:选择题
近年来科学家制造出大量的新物质,对下列三种物质的相关说法的不正确的是
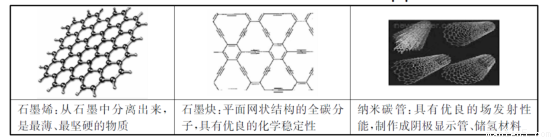
A.石墨烯具有良好的导电性
B.上述三种物质与金刚石互为同素异形体
C.石墨炔孔径略大于氢气分子的直径,可作压的提纯氢气薄膜
D.上述三种物质与浓硫酸都能发生反应,但反应产物不同
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上学期二次质检化学试卷(解析版) 题型:选择题
下列表述正确的是

A.还原性F->Cl->S2- B.原子半径:Na>Mg>O
C.酸性:H3PO4>H2SO4>HClO4 D.乙烯比例模型
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省大连市高三上12月月考理综化学试卷(解析版) 题型:填空题
Ⅰ、NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是____________________________________________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1的NH4Al(SO4)2中c(NH)________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH)。
(3)均为0.1 mol·L-1的几种电解质溶液的pH随温度变化的曲线如图所示。
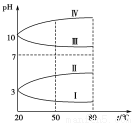
①其中符合0.1mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________,导致pH随温度变化的原因是__________________________________;
②20℃时,0.1mol·L-1的NH4Al(SO4)2中2c(SO)-c(NH)-3c(Al3+)=________(取近似值)
(4)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:
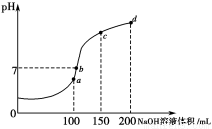
试分析图中a、b、c、d四个点,水的电离程度最大的是________点;在b点,溶液中各离子浓度由大到小的排列顺序是_______________________________
Ⅱ、为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
操作步骤 | 现象 |
步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2mol·L-1 Fe(NO3)3溶液。 | 溶液变红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。 | 现象a,溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。 | 出现黄色沉淀。 |
(1)写出步骤2中溶液变红色的离子方程式 。
(2)步骤3中现象a 。
(3)用化学平衡原理解释步骤4的实验现象
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二上第二次月考化学试卷(解析版) 题型:选择题
有文献报道,硫在空气中燃烧时,产物中SO3约占5% ~ 6%(体积比,下同),而硫在纯氧气中燃烧时,其产物中的SO3约占2% ~ 3%,解释这一事实的理由正确的是( )
A.在空气中燃烧时,硫的燃烧热小,使化学平衡向有利于生成SO3的方向移动
B.在纯氧气中燃烧时,硫的燃烧热大,不利于化学平衡向生 成SO3的方向移动
成SO3的方向移动
C.在硫燃烧的过程中,对于SO3的生成,温度的影响大于氧气浓度的影响
D.没有使用催化剂
查看答案和解析>>
科目:高中化学 来源:2016届内蒙古赤峰二中高三上学期12月月考理综化学试卷(解析版) 题型:简答题
尿素是蛋白质代谢的产物,也是重要的化学肥料。工业合成尿素反应如下:
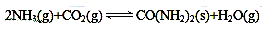
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图所示。
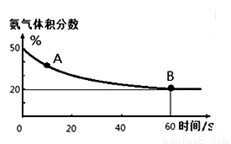
①A点的正反应速率v正(CO2)_______B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);
氨气的平衡转化率为________________________。
②关于上述反应的平衡状态下列说法正确的是________________
A.分离出少量的尿素,反应物的转化率将增大
B.平衡时再充入一定量NH3 (g),CO2的转化率增大
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高尿素的产率
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4(l) (氨基甲酸铵) △H1
H2NCOONH4(l) (氨基甲酸铵) △H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如下图Ⅰ所示:
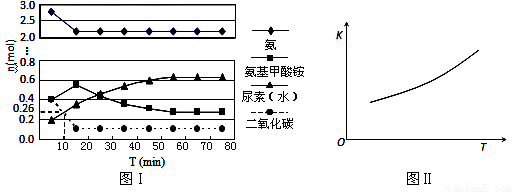
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第_______步反应决定,总反应进行到 _______ min时到达平衡。
②反应进行到10 min时测得CO2的物质的量如图所示,则用CO2表示的第一步反应的速率v(CO2)=_________ 。
③第二步反应的平衡常数K随温度的变化如上右图Ⅱ所示,则△H2 ________0(填“>”“<”或“=”)
④第一步反应的△S ________0(填“>”、“<”或,“=”),在________(填“较高”或“较低”)温度下有利于该反应自发进行。
(3)氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底。将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素。此时溶液中c(NH4+)= _____________________;NH4+水解平衡常数值为______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东广州执信中学高二上期中文化学试卷(解析版) 题型:?????
碳元素可以存在于自然界的多种物质中,这些物质肯定不包括( )
A.石油 B.石灰石 C.天然气 D.石英
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com