
 ;
;分析 (1)K原子的电子排布式为1s22s22p63s23p64s1,s有1种伸展方向,p有3中,电子填充了10个轨道,硫原子的核外电子排布式为,1s22s22p63s23p4;电子层数越多,半径越大,相同电子层结构,原子序数越小半径越大;
(2)K2S是离子化合物,硫离子和钾离子形成离子键,据此写出电子式;C02是直线形分子,碳原子与2个氧原子都形成双键,据此写出结构式;
(3)S和氯水反应会生成两种强酸,可知酸为盐酸和硫酸,然后配平;
(4)先根据质量守恒确定氢气的质量,然后求出氮原子、氢原子的物质的量,两者的物质的量之比,确定化合物的分子式,最后书写化学方程式.
解答 解:(1)K原子的电子排布式为1s22s22p63s23p64s1,原子核外电子云有4种不同的伸展方向,电子填充了10个轨道;硫原子的核外电子排布式为,1s22s22p63s23p4;电子层数越多,半径越大,相同电子层结构,原子序数越小半径越大,故半径K>S>C>N>O,故答案为:4;10;1s22s22p63s23p4;K>S>C>N>O;
(2)C02是直线形分子,碳原子与2个氧原子都形成双键,结构式为O=C=O,硫化钾是离子化合物,硫离子和钾离子形成离子键,硫化钾的电子式为 ;
;
故答案为:O=C=O; ;
;
(3)S和氯水反应会生成盐酸和硫酸,反应的离子方程式为:3Cl2+S+4H2O=8H++SO42-+6Cl-,
故答案为:3Cl2+S+4H2O=8H++SO42-+6Cl-;
(4)86g该化合物爆炸分解会生成标况下N2 67.2L和另一种气体单质H2,N2的物质的量为$\frac{67.2L}{22.4L/mol}$=3mol,质量为3mol×28g/mol=84g,则氢气的质量为86g-84g=2g,物质的量为1mol,氮原子、氢原子的物质的量分别为6mol,2mol,两者的物质的量之比为3:1,含氮化合物的分子式为HN3,化学方程式为:2HN3=H2+3N2,
故答案为:2HN3=H2+3N2.
点评 本题考查了含氮化合物的综合应用,题目难度中等,涉及知识点较多、综合性较强,充分考查了学生运用信息解决问题、分析问题的能力及知识的迁移与运用能力.


科目:高中化学 来源: 题型:选择题
| A. | SO2具有强氧化性,故可作漂白剂 | |
| B. | 可通过加热氯化铵固体使其分解的办法来制备氨气 | |
| C. | 浓硝酸中的HNO3见光会分解,故要盛放在棕色试剂瓶中 | |
| D. | Fe在Cl2中燃烧生成FeCl3,故在与其他非金属反应的产物中的Fe也显+3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
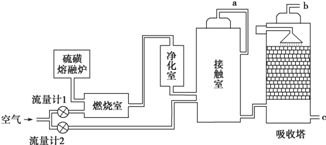
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(甲):c(乙)=1:10 | B. | c(H+)甲:c(H+)乙=1:2 | ||
| C. | c(OH-)甲:c(OH-)乙=10:1 | D. | a(甲):a(乙)=2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Al3+、NH4+、SO42- | B. | Ag+、NO3-、Na+、Ba2+ | ||
| C. | Fe2+、NO3-、SO42-、Na+ | D. | K+、CO32-、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
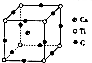 短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2np2,C元素位于第二周期且原子中p能级与所有s能级电子总数相等,D元素原子的L层能级中有3个未成对电子.
短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2np2,C元素位于第二周期且原子中p能级与所有s能级电子总数相等,D元素原子的L层能级中有3个未成对电子.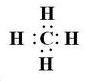 ,BC2属于非极性分子(填”极性“或”非极性“);当n=3时,B与C形成的晶体属于原子晶体.
,BC2属于非极性分子(填”极性“或”非极性“);当n=3时,B与C形成的晶体属于原子晶体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com