
| O2 |
| 800℃ |
| O2 |
| △① |
| Cu2S |
| △② |
| 1 |
| 2 |
| m |
| V |
| O2 |
| 800℃ |
| O2 |
| △① |
| Cu2S |
| △② |
| 1 |
| 2 |
| 1 |
| 8 |
| m |
| V |
| ||
| a3 |
| 320 |
| a3?NA |
| 320 |
| a3?NA |


 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
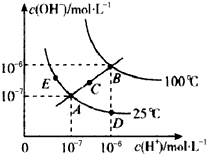
| A、从图中可以看出,水的电离是吸热过程 |
| B、若从A点到D点,可采用:温度不变在水中加入适量的NH4Cl固体 |
| C、在处于C点状态的溶液中:Na+、Al3+、CO32-、Cl-能够大量共存 |
| D、在处于E点状态的CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(OH+)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体 | B、悬浊液 |
| C、溶液 | D、乳浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
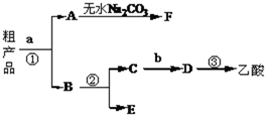 实验室合成乙酸乙酯的步骤:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸汽冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:
实验室合成乙酸乙酯的步骤:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸汽冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com