
| ||
. |
| ||
. |
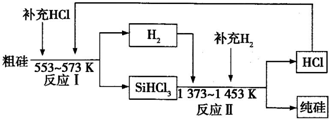
| ||
| 3 |
| 90% |
| 1 |
| 93.95% |
| ||
| ||
| 3 |
| 90% |
| 1 |
| 93.95% |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 2012年3月21 日是第二十届“世界水日”,保护水资源,从我做起!
2012年3月21 日是第二十届“世界水日”,保护水资源,从我做起!查看答案和解析>>
科目:高中化学 来源: 题型:
| A、足量Cl2通入FeBr2溶液中:2Br-+Cl2=Br2+2Cl- |
| B、用NaClO除去水体中CO(NH2)2产生CO2和N2:3ClO-+CO(NH2)2=3Cl-+CO2↑+N2↑+2H2O |
| C、过量CO2通入Na2SiO3溶液中:Si032-+CO2+H2O=H2SiO3↓+CO32- |
| D、Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向溴化亚铁溶液中通入过量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| B、将碳酸氢铵溶液与足量烧碱溶液反应:HCO3-+OH-=CO32-+H2O |
| C、将1 mol?L-1的NaAlO2溶液和2.5 mol?L-1的HCl溶液等体积均匀混合:AlO2-+H++H2O=Al(OH)3↓ |
| D、向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至Al3+恰好完全沉淀2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石灰石溶于醋酸中:CaCO3+2H+═Ca2++CO2↑+H2O |
| B、向Ba(OH)2溶液中滴加NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+NH4++H++SO42-═BaSO4↓+NH3?H2O+H2O |
| C、将少量SO2气体通入足量的NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO |
| D、稀硝酸中加入过量的铁屑:3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化剂是H3AsO3 |
| B、还原性:Cr>As |
| C、每生成1mol As,反应中转移电子的物质的量为6mol |
| D、M为OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L HCN的溶液,其pH>1 |
| B、CN-可被Cl2氧化成(CN)2 |
| C、在水溶液中(CN)2可被F-还原 |
| D、HCN的结构式为H-C≡N |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,2.24L SO3含有的分子数为0.1nA |
| B、常温下,3.0g甲醛含有C-H键数目为0.2nA |
| C、含有2mol H2SO4的浓硫酸与足量Cu在加热条件下充分反应,电子转移数是2nA |
| D、1L 1mol/L AlCl3溶液含Al3+数目为nA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com