
| ||
| ||
| 1 |
| 3 |


科目:高中化学 来源: 题型:
| A、稀硝酸具有氧化性,可用于清洗做银镜反应的试管 |
| B、BaSO4、BaCO3均难溶于水,都可用作钡餐 |
| C、铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝 |
| D、加热盛有NH4Cl固体的试管,管口有固体凝结,这是升华现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大理石溶于盐酸中:CO32-+2H+=CO2↑+H2O |
| B、氯化铝加到过量氢氧化钠溶液中:Al3++4OH-=[Al(OH)4]- |
| C、(NH4)2CO3溶液中加入过量Ba(OH)2溶液:NH4++OH-=NH3↑+H2O |
| D、氯化铁溶液中加入铜片:Fe3++Cu=Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
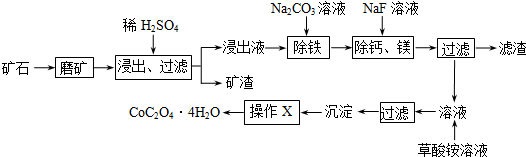

| c(Ca2+) |
| c(Mg2+) |
| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、医用药品应在低温、干燥的环境下密封保存 |
| B、反应中的某一物质的转化率α(B)增大,则该反应的平衡常数K一定增大 |
| C、向一堆篝火“鼓风”,有助于它继续燃烧下去 |
| D、微量的MnO2粉末可以使过氧化氢快速分解,而MnO2的质量在反应前后并没发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 镁的质量 | 镁的规格 | 盐酸的体积 | 盐酸的浓度 | 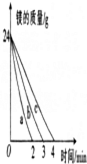 |
| ① | 24g | 镁条 | 500mL | 6mol?L-1 | |
| ② | 24g | 24g镁条 剪成100段 | 500mL | 6mol?L-1 | |
| ③ | 24g | 镁粉 | 500mL | 6mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
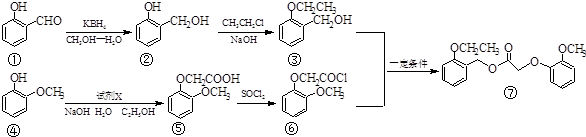
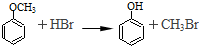
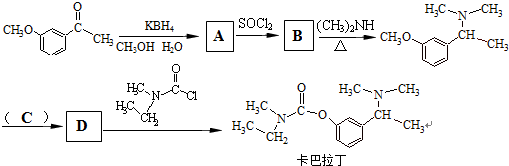
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子化合物中不一定含有离子键 |
| B、单质分子中均不存在化学键 |
| C、由C元素形成的单质不一定是原子晶体 |
| D、含有共价键的化合物一定是共价化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com