
| 0.03mol |
| 0.02L |
| 1.463 |
| 0.03 |


科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Cu2+、Ba2+、Cl-、SO
| ||
B、Na+、Fe3+、SCN-、SO
| ||
| C、H+、Na+、CH3COO-、Cl- | ||
D、K+、NH
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体的密度保持不变 |
| B、有1mol C生成的同时有1mol D生成 |
| C、混合气体的总物质的量保持不变 |
| D、有1mol A生成的同时有1mol C消耗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
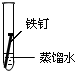
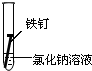
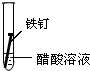
| 实验序号 | I | II | III |
| 实验 内容 |
 |
 |
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
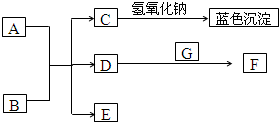 图中A~G均为中学化学中常见的物质,它们之间有如下转化关系.常温下,A为紫红色金属固体,B为常见的强酸,G在空气中含量为21%的气态单质;D、F都是大气污染物,主要来源于汽车尾气,D为无色气体,F为红棕色气体.
图中A~G均为中学化学中常见的物质,它们之间有如下转化关系.常温下,A为紫红色金属固体,B为常见的强酸,G在空气中含量为21%的气态单质;D、F都是大气污染物,主要来源于汽车尾气,D为无色气体,F为红棕色气体.查看答案和解析>>
科目:高中化学 来源: 题型:
A、2Mg+O2
| ||||
| B、HCl+NaOH=NaCl+H2O | ||||
C、C+H2O
| ||||
| D、CaO+H2O=Ca(OH)2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com