
在2.00L的密闭容器中,反应2A(g) B(g)+ C(g)分别在三种不同实验条件下进行,但起始浓度相同,均为c(A)=0.100mol/L、c(B)=0.020mol/L及c(C)=0.020mol/L。反应物A的浓度随时间的变化如下图所示:
B(g)+ C(g)分别在三种不同实验条件下进行,但起始浓度相同,均为c(A)=0.100mol/L、c(B)=0.020mol/L及c(C)=0.020mol/L。反应物A的浓度随时间的变化如下图所示: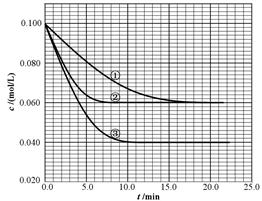
请回答下列问题:
(1)以下说法能说明该反应已达到平衡状态的是: (填序号)
①c(A):c(B):c(C)=2:1:1
②v(A)=" 2" v(B)
③体系的压强不再改变
④A的质量分数不再改变
⑤混合气体的密度不再改变
(2)根据实验③回答:反应开始到4.0min时反应物A的转化率为 ,
B平均反应速率为 。
(3)与①比较,②和③分别仅改变一种反应条件。所改变的条件是:
② ;③ 。
(4)实验①条件下该反应的化学平衡常数值是 。若实验①到达平衡后,维持体系温度不变,往容器中再投入0.028mol B和0.028mol C,求新平衡时体系中A的物质的量浓度。(写出计算过程)
(1)④(2)40%,0.005mol/(L·min) (3)②使用合适的催化剂;③升温
(4)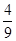
往体系中再投入0.028molB和0.028molC后,平衡向左移动,设转化的B的物质的量浓度为x
2A (g)  B(g) + C (g)
B(g) + C (g)
旧平衡(mol/L) 0.060 0.040 0.040
新起始(mol/L) 0.060 0.040+0.014 0.040+0.014
转化(mol./L) 2x x x
新平衡(mol/L) 0.060+2x 0.054-x 0.054-x
K= x = 0.006mol/L
x = 0.006mol/L
再次达到平衡时A的物质的量浓度:c(A) =" (0.060+0.006×2)" mol/L =" 0.072" mol/L
解析试题分析:(1)当A消耗0.03mol/L时,即c(A)=0.07mol/L时,c(A):c(B):c(C)=2:1:1,图中c(A)=0.07mol/L时不是平衡状态,①错误;A、B速率比等于2:1,但未知是正反应速率还是逆反应速率,②错误;反应前后气体的计量数不变,当容器的体积和温度不变时,反应前后体系压强不变,③错误;A的质量分数不变说明反应达到平衡状态,④正确;反应物、生成物都是气体,气体质量守恒,容器容积固定,所以气体的密度不变,⑤错误。(2)实验③中,前4min时,A浓度变化为0.04mol/L,A的转化率为0.04/0.1=0.4;v(A)=0.01mol/(L·min),所以v(B)=0.005mol/(L·min)。(3)①、②起始时和平衡时A的浓度相同,但②比①先达到平衡,改变的条件是使用正催化剂;①、③起始时A的浓度相同,但③比①先达到平衡,说明改变的条件可能是升高温度或增大压强,增大压强平衡不移动,平衡时③比①A的浓度小,改变的条件是升高温度。(4)实验①平衡时c(A)=0.06mol/L,所以转化的c(A)=0.04mol/L,生成的c(B)=c(C)=0.02mol/L,K=c(B)c(C)/c2(A)=0.04×0.04/0.062=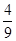 。平衡后,保持温度不变,向容器中再投入B和C,反应平衡常数不变。往体系中再投入0.028molB和0.028molC后,平衡向左移动,设转化的B的物质的量浓度为x
。平衡后,保持温度不变,向容器中再投入B和C,反应平衡常数不变。往体系中再投入0.028molB和0.028molC后,平衡向左移动,设转化的B的物质的量浓度为x
2A (g)  B(g) + C (g)
B(g) + C (g)
旧平衡(mol/L) 0.060 0.040 0.040
新起始(mol/L) 0.060 0.040+0.014 0.040+0.014
转化(mol./L) 2x x x
新平衡(mol/L) 0.060+2x 0.054-x 0.054-x
K= x = 0.006mol/L
x = 0.006mol/L
再次达到平衡时A的物质的量浓度:c(A) =" (0.060+0.006×2)" mol/L =" 0.072" mol/L
考点:化学平衡状态的标志 转化率 化学反应速率及影响因素 化学平衡常数
点评:化学平衡常数是温度的函数,对于同一反应,只要温度不变,化学平衡常数不变,该条件经常隐含在题设条件中。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
| 化学键 | H-H | C-H | C-C | C=C |
| 吸收或放出的能量 E/(kJ.mol-1) |
435.3 | 414.4 | 345.6 | 615.3 |
查看答案和解析>>
科目:高中化学 来源:2010年广东省广州市高考化学模拟试卷(三)(解析版) 题型:填空题
| 化学键 | H-H | C-H | C-C | C=C |
| 吸收或放出的能量 E/(kJ.mol-1) | 435.3 | 414.4 | 345.6 | 615.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com