
| A. | a>c>b | B. | a=b=c | C. | a=c>b | D. | a>c=b |
分析 ①强酸和强碱的稀溶液反应生成可溶性盐与1mol水,放出的热量为57.3kJ;
②盐类的水解吸收热量;
③因为HAc是弱酸,电离要消耗能量.
解答 解:①H+(aq)+OH-(aq)→H2O(l)+a kJ表示强酸和强碱的稀溶液反应生成可溶性盐与1mol水,放出的热量为57.3kJ,a=57.3;
②NH4+(aq)+H2O(l)H+(aq)+NH3•H2O(aq)+b kJ表示铵根离子水解生成弱碱一水合氨,水解吸收热量,b<0;
③HAc(aq)+OH-(aq)→Ac-(aq)+H2O(l)+c kJ醋酸与可溶性的强碱反应生成1mol水,因为醋酸是弱酸,电离要消耗能量,所以放出的热量小于57.3kJ,0<C<57.3;
所以三个反应的放出热量①>③>②,即a>c>b.
故选A.
点评 本题考查反应热大小的比较,注意中和热:强酸和强碱的稀溶液反应生成可溶性盐与1mol水,反应热才是57.3kJ/mol,如果是浓溶液会大于57.3kJ/mol,因为浓酸和浓碱稀释放热,如果是弱酸和弱碱会小于57.3kJ/mol,因为弱酸和弱碱电离需要吸热,②为盐的水解吸热,题目难度不大.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | h1>h2>h3>h4 | B. | h4>h3>h2>h1 | C. | h4>h1>h3>h2 | D. | h2>h3>h1>h4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 代号 | 物质 | 结构式 | 水中溶解度/g(25℃) | 熔点/℃ |
| A | 邻-硝基苯酚 | 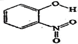 | 0.2 | 45 |
| B | 对-硝基苯酚 | 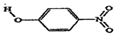 | 1.7 | 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的比例模型: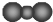 | B. | N原子最外层轨道表示式: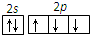 | ||
| C. | Cl原子的结构示意图: | D. | Al原子最外层电子排布式:3s23p1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| B. | 2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | |
| C. | Mg2++H++2SO42-+2Ba2++3OH-=Mg(OH)2↓+2BaSO4↓+H2O | |
| D. | 3Mg2++2H++4SO42-+4Ba2++8OH-=3Mg(OH)2↓+4BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
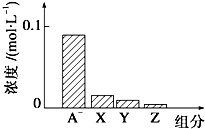 常温下,0.2mol•L-1NaHA与等浓度等体积的NaOH溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.2mol•L-1NaHA与等浓度等体积的NaOH溶液混合,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )| A. | NaHA溶液显酸性 | |
| B. | 混合溶液中水电离出的C(OH-)、C(H+)相等 | |
| C. | 图中X、Y、Z分别代表OH-、HA-、H+ | |
| D. | 混合溶液中:C(Na+)=C(H2A)+C(HA-)+C(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
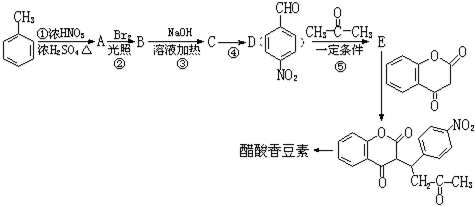

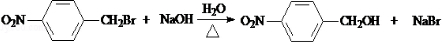 .
.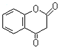 互为同分异构体且同时符合下列条件的有机物的结构简式为
互为同分异构体且同时符合下列条件的有机物的结构简式为
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,饱和CaCO3溶液与饱和CaF2溶液等体积混合,不会析出CaF2固体 | |
| B. | 25℃时,饱和CaCO3溶液与饱和CaF2溶液相比,前者Ca2+浓度大 | |
| C. | 25℃时,在CaCO3悬浊液中加人NaF固体,CaCO3全部溶解 | |
| D. | 25℃时,CaCO3固体在盐酸中的Ksp比在氨水中的Ksp大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com