
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理 ???????????????????????????????????? 。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是????? (填序号)
A.Ba(NO3)2? ???? B.BaCl2? ?? ? C.Ba(OH)2??? ???? D.溶有NH3的BaCl2溶液
③若将足量SO2气体通入0.2 mol·L-1的NaOH溶液,所得溶液呈酸性,则溶液中离子浓度由大到小的顺序为?????????????????????????? 。
(2)采用电解法处理含有Cr2O72-的酸性废水,在废水中加入适量NaCl,用铁电极电解一段时间后,有Cr(OH)3和Fe(OH)3沉淀生成,从而降低废水中铬元素的含量。若阳极用石墨电极则不能产生Cr(OH)3沉淀,用必要的化学语言说明原因___________________。
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。如图是该燃料电池示意图,产生的X气体可直接排放到大气中。a电极作??????? 极(填“正”“负”“阴”或“阳”),其电极反应式为??????? ;T℃下,某研究员测定NH3·H2O的电离常数为1.8×10-5,NH4+的水解平衡常数为1.5×10-8(水解平衡也是一种化学平衡,其平衡常数即水解常数),则该温度下水的离子积常数为?????????? ,请判断T?????? 25℃(填“>”“<”“=”)。

(1)①FeS(s)+Cu2+(aq)= CuS(s)+ Fe 2+(aq)
②A C D
③c(Na+)>c(HSO3-)> c (H+)>c(SO32-)> c(OH-)。
(2)因为Fe电极在电解过程中产生还原性的Fe2+,将溶液中Cr2O72-还原为Cr3+,Cr2O72-+6Fe2++14H+ =2Cr3++6Fe3++7H2O。若改用石墨电极,阳极产生的是Cl2,不能将Cr2O72-还原为Cr3+。
(3)负?? 2NH3+6OH--6e- =N2+6H2O??? 2.7×10-13;>
【解析】
试题分析:(1) FeS尽管难溶,也有一定的溶解度,在溶液中存在着沉淀溶解平衡:FeS(s)  Fe2+(aq)+S2-(aq) ,由于Ksp(FeS)=6.3×10-18mol2·L-2>>Ksp(CuS)=1.3×10-36mol2·L-2,所以当溶液中含有Cu2+时,Cu2+就会与FeS电离产生的S2-结合产生更难溶的沉淀CuS。Cu2++ S2-=CuS↓,FeS再溶解电离,产生的S2-再反应变为CuS沉淀。最终能够把溶液中的Cu2+完全沉淀除去。反应的两种方程式为:①FeS(s)+Cu2+(aq)= CuS(s)+ Fe 2+( aq).? ② SO2+H2O=H2SO3,溶液显酸性。A.当向其中加入Ba(NO3)2时,也就相当于存在硝酸。硝酸有强氧化性,能把H2SO3氧化产生H2SO4.故会产生BaSO4沉淀。正确。B.假如能与BaCl2 发生反应,则反应的方程式为:B.BaCl2+ SO2+H2O=BaSO3↓+2HCl. BaSO3能与HCl发生反应,所以在酸性环境不存在。即该反应是不能发生的。换句话说就是不能发生反应产生沉淀。C.酸性氧化物SO2能与碱发生反应:Ba(OH)2+ SO2=BaSO3↓+ H2O.正确。D.首先发生反应:2NH3+ SO2+H2O= (NH4)2SO3,然后发生:(NH4)2SO3+BaCl2= BaSO3↓+ 2NH4Cl .正确。因此选项为A、C、D。③由于SO2足量。所以反应的方程式为:SO2+NaOH=NaHSO3。NaHSO3=Na++HSO3-。HSO3-在溶液中存在电离平衡HSO3-
Fe2+(aq)+S2-(aq) ,由于Ksp(FeS)=6.3×10-18mol2·L-2>>Ksp(CuS)=1.3×10-36mol2·L-2,所以当溶液中含有Cu2+时,Cu2+就会与FeS电离产生的S2-结合产生更难溶的沉淀CuS。Cu2++ S2-=CuS↓,FeS再溶解电离,产生的S2-再反应变为CuS沉淀。最终能够把溶液中的Cu2+完全沉淀除去。反应的两种方程式为:①FeS(s)+Cu2+(aq)= CuS(s)+ Fe 2+( aq).? ② SO2+H2O=H2SO3,溶液显酸性。A.当向其中加入Ba(NO3)2时,也就相当于存在硝酸。硝酸有强氧化性,能把H2SO3氧化产生H2SO4.故会产生BaSO4沉淀。正确。B.假如能与BaCl2 发生反应,则反应的方程式为:B.BaCl2+ SO2+H2O=BaSO3↓+2HCl. BaSO3能与HCl发生反应,所以在酸性环境不存在。即该反应是不能发生的。换句话说就是不能发生反应产生沉淀。C.酸性氧化物SO2能与碱发生反应:Ba(OH)2+ SO2=BaSO3↓+ H2O.正确。D.首先发生反应:2NH3+ SO2+H2O= (NH4)2SO3,然后发生:(NH4)2SO3+BaCl2= BaSO3↓+ 2NH4Cl .正确。因此选项为A、C、D。③由于SO2足量。所以反应的方程式为:SO2+NaOH=NaHSO3。NaHSO3=Na++HSO3-。HSO3-在溶液中存在电离平衡HSO3- H++SO32-和水解平衡HSO3-+ H2O
H++SO32-和水解平衡HSO3-+ H2O  H2SO3+OH-。电离使溶液显酸性,水解使溶液显碱性。因为所得溶液呈酸性,所以电离大于水解。c (H+)>c(OH-).在溶液中除了存在水解平衡外还存在H2O
H2SO3+OH-。电离使溶液显酸性,水解使溶液显碱性。因为所得溶液呈酸性,所以电离大于水解。c (H+)>c(OH-).在溶液中除了存在水解平衡外还存在H2O  H++OH-,SO32-只有HSO3-电离产生,所以c (H+)>c(SO32-) 。电解质的电离程度:HSO3-> H2O。因此c(SO32-)> c(OH-)。无论HSO3-是电离还是水解都要消耗,所以c(Na+)>c(HSO3-).因此溶液中各种离子的浓度关系为:c(Na+)>c(HSO3-)> c (H+)>c(SO32-)> c(OH-)。(2) 用铁电极电解一段时间后, Fe(OH)3沉淀生成,说明Fe与电源的正极相连接,作阳极,被氧化发生还原反应:Fe-2e-=Fe2+.产生的Fe2+有还原性,能将溶液中Cr2O72-还原为Cr3+,二者发生的反应为:Cr2O72-+6Fe2++14H+ =2Cr3++6Fe3++7H2O,Cr3+与Fe3+水解产生Cr(OH)3和Fe(OH)3沉淀,从而可以降低废水中铬元素的含量。若阳极用石墨电极,则电极本身不参加反应,是溶液中的Cl-失去电子。在阳极产生的是Cl2,就不能将Cr2O72-还原为Cr3+。(3)氨设计成碱性燃料电池,产生的X气体可直接排放到大气中。则X为N2,a电极作负极,电极反应为2NH3+6OH--6e- =N2+6H2O。通入空气的电极为正极,发生反应:O2+4e-+2H2O=4OH-。NH3·H2O
H++OH-,SO32-只有HSO3-电离产生,所以c (H+)>c(SO32-) 。电解质的电离程度:HSO3-> H2O。因此c(SO32-)> c(OH-)。无论HSO3-是电离还是水解都要消耗,所以c(Na+)>c(HSO3-).因此溶液中各种离子的浓度关系为:c(Na+)>c(HSO3-)> c (H+)>c(SO32-)> c(OH-)。(2) 用铁电极电解一段时间后, Fe(OH)3沉淀生成,说明Fe与电源的正极相连接,作阳极,被氧化发生还原反应:Fe-2e-=Fe2+.产生的Fe2+有还原性,能将溶液中Cr2O72-还原为Cr3+,二者发生的反应为:Cr2O72-+6Fe2++14H+ =2Cr3++6Fe3++7H2O,Cr3+与Fe3+水解产生Cr(OH)3和Fe(OH)3沉淀,从而可以降低废水中铬元素的含量。若阳极用石墨电极,则电极本身不参加反应,是溶液中的Cl-失去电子。在阳极产生的是Cl2,就不能将Cr2O72-还原为Cr3+。(3)氨设计成碱性燃料电池,产生的X气体可直接排放到大气中。则X为N2,a电极作负极,电极反应为2NH3+6OH--6e- =N2+6H2O。通入空气的电极为正极,发生反应:O2+4e-+2H2O=4OH-。NH3·H2O  NH4++OH-,
NH4++OH-, 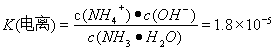 - NH4++ H2O
- NH4++ H2O  H+ + NH3·H2O,
H+ + NH3·H2O, 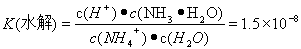 .将两式相乘,可得
.将两式相乘,可得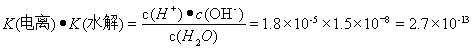 。c (H+)·c(OH-)=K(电离) ·K(水解) ·c(H2O)=Kw. 所以在该温度下水的离子积常数Kw=2.7×10-13.水是弱电解质,升高温度,促进水的电离,水电离产生的离子浓度增大,水的离子积常数也增大。由于2.7×10-13>1.0×10-14.所以温度高于25℃。
。c (H+)·c(OH-)=K(电离) ·K(水解) ·c(H2O)=Kw. 所以在该温度下水的离子积常数Kw=2.7×10-13.水是弱电解质,升高温度,促进水的电离,水电离产生的离子浓度增大,水的离子积常数也增大。由于2.7×10-13>1.0×10-14.所以温度高于25℃。
考点:考查沉淀的转化、SO2的除去方法、含有Cr2O72-的酸性废水的电解法处理、原电池的反应原理及电极式的书写、弱电解质的电离平衡、盐的水解平衡、水的离子积常数的计算的知识。


科目:高中化学 来源: 题型:阅读理解
| 分析推测 | 实验步骤 | ||
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应: Fe3++6SO2 Fe(SO2)
|
ⅰ.制备Fe(OH)3胶体并检验 ⅱ.分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
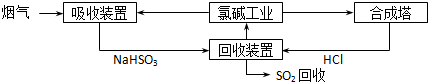
| 分析推测 | 实验步骤 |
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应: Fe3++6SO2 Fe(SO2) 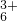 (反应b) (反应b) | ⅰ.制备Fe(OH)3胶体并检验 ⅱ.分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源:东城区二模 题型:填空题
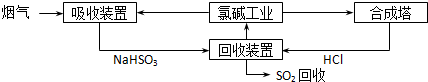
| 分析推测 | 实验步骤 | ||
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应: Fe3++6SO2 Fe(SO2)
|
ⅰ.制备Fe(OH)3胶体并检验 ⅱ.分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源:2012年北京市东城区高考化学二模试卷(解析版) 题型:解答题
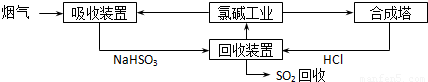
| 分析推测 | 实验步骤 |
| 甲:生成了Fe(OH)3胶体 乙:经查阅资料,可能发生反应: Fe3++6SO2 Fe(SO2) 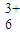 (反应b) (反应b) | ⅰ.制备Fe(OH)3胶体并检验 ⅱ.分别向Fe(OH)3胶体和该红褐色液体中加入适量铁粉,振荡后前者不变色,后者变为浅绿色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com