
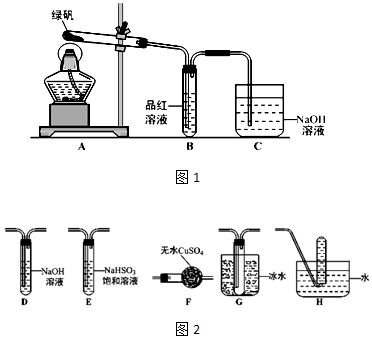
分析 (1)二氧化硫能使品红溶液褪色,二氧化硫污染空气,不能直接排放至空气中;
(2)根据题意SO3氧化性及脱水性较浓硫酸强,能漂白某些有机染料,如品红分析;
(3)检验绿矾分解气态产物,由A分解绿矾,经F干燥,二氧化硫三氧化硫均能漂白品红,故先检验三氧化硫并与二氧化硫分离,三氧化硫熔沸点低,故连接G装置冷凝三氧化硫,由装置B检验二氧化硫,经过装置D除去二氧化硫,连接装置H,收集氧气,利用氧气的助燃性检验氧气;
(4)根据三价铁离子使KSCN溶液显红色分析.
解答 解:(1)甲组由此得出绿矾的分解产物中含有SO2,装置B为品红,二氧化硫有漂白性,故装置B中褪色;二氧化硫污染环境,用氢氧化钠吸收;
故答案为:品红溶液褪色;吸收尾气,防止SO2(SO3)等气体扩散到空气中污染环境;
(2)根据题意SO3氧化性及脱水性较浓硫酸强,能漂白某些有机染料,如品红,三氧化硫的漂白不可恢复,乙对甲组同学做完实验的B装置的试管加热,发现褪色的品红溶液未恢复红色,则可证明绿矾分解的产物中肯定有三氧化硫,未对二氧化硫检验,故可能含有二氧化硫;
故答案为:BC;
(3)①检验绿矾分解气态产物,由A分解绿矾,经F干燥,二氧化硫三氧化硫均能漂白品红,故先检验三氧化硫并与二氧化硫分离,三氧化硫熔沸点低,故连接G装置冷凝三氧化硫,由装置B检验二氧化硫,经过装置D除去二氧化硫,连接装置H,检验氧气;
故答案为:AFGBDH;
②氧气收集在H中,利用氧气支持燃烧检验,方法为:把H中的导管移出水面,撤走酒精灯,用姆指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气;
故答案为:把H中的导管移出水面,撤走酒精灯,用姆指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气;
(4)三价铁使KSCN溶液显红色,为证明绿矾分解产物中含有三价铁,则应用药匙取用分解产物于试管中,加盐酸溶解,再用胶头滴管向其中滴入KSCN溶液,若变红,则含有三价铁离子;
故答案为:取少量分解产物于试管中,加入足量稀盐酸溶解,再滴加几滴KSCN溶液,溶液变红色,说明有三价铁.
点评 本题考查性质实验方案设计,侧重考查学生知识综合应用、根据实验目的及物质的性质进行排列顺、实验基本操作能力及实验方案设计能力,综合性较强,注意把握物质性质以及对题目信息的获取于使用,题目难度中等.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素C、D形成的简单离子半径,前者大于后者 | |
| B. | F的热稳定性比H2S弱 | |
| C. | 化合物A、F中化学键的类型相同 | |
| D. | 元素C、D的最高价氧化物的水化物均可以和H发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KNO3的溶解度高于NaCl | |
| B. | KNO3的溶解度低于NaCl | |
| C. | 含有多种杂质时,KNO3比NaCl更适合利用降温结晶(或重结晶)法进行提纯 | |
| D. | 含有多种杂质时,NaCl比KNO3更适合利用降温结晶(或重结晶)法进行提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 实验操作 | 现象或结论 |
| ① | 测饱和NaHCO3溶液的pH | pH为8.3 |
| ② | 向2mL Na2CO3溶液中加入MgCl2溶液 | 有白色沉淀生成 |
| ③ | 向2mL饱和NaHCO3溶液中加入MgCl2溶液 | 无明显现象 |
| ④ | 向20mL 饱和NaHCO3溶液中加入少量的NaHCO3固体,静置24小时 | 溶液中微小的气体缓慢地从底部固体逸出,最终固体全部溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 短周期主族元素R、X、Y、Z、M的原子序数依次增太,它们占据三个周期.Y和M位于同主族,Y原子的最外层电子数是电子层数的3倍.这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向溶液中滴加氢氧化钠稀溶液,产生沉淀的物质的量与加入氢氧化钠溶液的体积的关系如图所示.下列说法不正确的是( )
短周期主族元素R、X、Y、Z、M的原子序数依次增太,它们占据三个周期.Y和M位于同主族,Y原子的最外层电子数是电子层数的3倍.这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向溶液中滴加氢氧化钠稀溶液,产生沉淀的物质的量与加入氢氧化钠溶液的体积的关系如图所示.下列说法不正确的是( )| A. | 简单的离子半径:M>Y>Z | |
| B. | 气态氢化物的热稳定性:Y>X | |
| C. | 最高价氧化物对应水化物的酸性:M>Z | |
| D. | 由R、X、Y、M四种元素只能组成一种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com