
废旧铅蓄电池的回收利用是发展循环经济的必经之路。其阴、阳极填充物(铅膏,主要含PbO、PbO2、PbSO4)是废旧铅蓄电池的主要部分,回收时所得黄丹(PbO)、碳酸铅可用于合成三盐基硫酸铅(组成可表示为3PbO·PbSO4·H2O),其工艺流程如下:
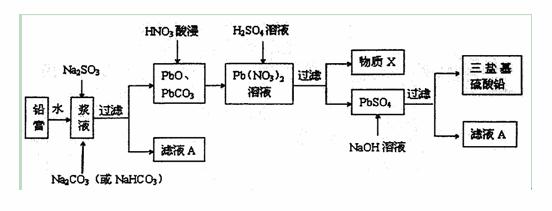
(1)用碳酸盐作转化剂,将铅膏中的硫酸铅转化为碳酸铅,写出转化反应方程式:
(2)滤液A能用来回收Na2SO4·10H2O,提取该晶体的主要步骤有____________、___________、过滤、洗涤、干燥;检验该晶体中阴离子的实验方法是________ ____。
(3)物质X是一种可循环使用的物质,其溶质主要是______________(填化学式),若X中残留的 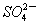 过多,循环利用时可能出现的问题是__________________。
过多,循环利用时可能出现的问题是__________________。
(4)生成三盐基硫酸铅的离子方程式为____________________。
(5)向铅膏浆液中加入Na2SO3溶液的目的是将其中的PbO2还原为PbO。若实验中所取铅膏的质量为47.8g,其中PbO2的质量分数为15%,则要将PbO2全部还原,至少需要加入______mL的0.5 mol/LNa2SO3溶液。
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水” 电池在海水中放电时的有关说法正确的是:
A.正极反应式:Ag+Cl--e-=AgCl
B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动
D. AgCl是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
一定量的甲烷燃烧后得到的产物为CO、CO2和水蒸气, 此混合气体质量为49.6g, 当
其缓慢经过无水CaCl2时, CaCl2增重25.2g。原混合气中CO2的质量为
A.12.5g B.13.2g C.19.7g D.24.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH;

②有关有机 物的沸点见下表:
物的沸点见下表:
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
请回答:
(1)浓硫酸的作用为______________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式__________ _________________________________________________________________。
(2)球形干燥管C的作用是__________________________________________
_________________________________________________________________。
若反应前D中加入几滴酚酞,溶液呈红色,反应结束后D中的现象是__________________________________________________________________
_________________________________________________________________。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出________;再加入(此空从下列选项中选择)________;然后进行蒸馏,收集77 ℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰
C.无水硫酸钠 D.生石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
有关右图的说法正确的是
A.构成原电池时溶液中SO42- 移向Cu极
B.构成原电池时Cu极反应为: Cu﹣2e-=Cu2+
C.要使Fe极不被腐蚀,Cu片换Zn片或a接直流电源负极
D.形成电解池,Cu电极不可能溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
海洋中有丰富的食品、矿产、能源、药物和水产资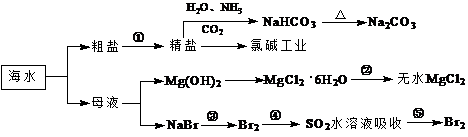 源,下图为海水利用的部分过程。下列有关说法正确的是
源,下图为海水利用的部分过程。下列有关说法正确的是
A.制取NaHCO3的反应是利用其溶解度小于NaCl
B.用澄清的石灰水可鉴别NaHCO3和Na2CO3
C.在第③、④、⑤步骤中,溴元素均被氧化
D.工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学——选修2:化学与技术】(15分)
化学是人类进步的关键,化学为人类的生产、生活提供了物质保证。
(1)电镀时,用镀层金属作阳极的作用是 .
为了使镀层厚度均匀、光滑致密、与镀件的附着力强,除控制溶液中离子浓度外,
通常还可以采取的措施有 。
(2)卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品。从卤水中提取镁的
步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2·6H2O;
d.将MgCl2·6H2O在一定条件下加热得到无水MgCl2;
e.电解熔融的氯化镁可得到Mg。
①步骤d中的“一定条件”指的是 ,目的是 。
上述提取镁的流程中,为了降低成本.减少污染,可以采取很多措施,请写出其中一点
②有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,你同意该同学的想法吗?为什么?
(3)铀是核反应最重要的燃料,已经研制成功一种螫合型离子交换树脂,它专门吸附海水中 的U4+,而不吸附其他元素。其反应原理为 (树脂用HR代替),发生离子交换后的离子交换膜用酸处理还可再生并得到含铀的溶液,其反应原理为: 。
(4)阿司匹林(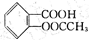 )在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因:
)在潮湿空气中可分解成水杨酸和醋酸而略带酸臭味,故密封保存,用化学方程式表示阿司匹林必须贮藏于密闭、干燥处的原因:
,此反应的类型属于 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物X(C4H6O5)广泛存在于许多水果内,尤以苹果、葡萄、西瓜、山楂内为多,
该化合物具有如下性质:
(1)1 molX与足量的金属钠反应产生1.5 mol气体
(2)X与醇或羧酸在浓H2SO4和加热的条件下均生成有香味的产物
(3)X在一定程度下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应
根据上述信息,对X的结构判断正确的是
A.X中肯定有碳碳双键 B.X中可能有三种羟基和一个 一COOR官能团
C.X中可能有三个羧基 D.X中可能有两个羧基和一个羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子或分子在溶液中能大量共存且满足相应要求的是 ( )
| 选项 | 离子或分子 | 要求 |
| A | K+、SO | c(K+)<c(SO |
| B | Fe3+、Na+、NO | 溶液pH=1 |
| C | Na+、Al3+、Cl-、SO | 滴加氨水立即有沉淀产生 |
| D | NH | 滴加NaOH溶液立即有气泡产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com