
| A. | Na | B. | K | C. | Cl | D. | F |
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
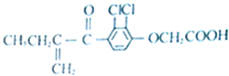
| A. | 分子中有4个碳碳双键 | |
| B. | 该有机物能发生银镜反应 | |
| C. | 既能发生还原反应,又能发生氧化反应 | |
| D. | 1mol该物质最大跟6mol氢气发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)某温度时,2L的密闭容器中X、Y、Z=种气体物质的物质的量随时间的变化如图 所示.
(1)某温度时,2L的密闭容器中X、Y、Z=种气体物质的物质的量随时间的变化如图 所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
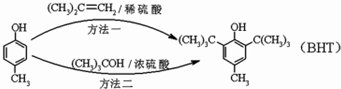 BHT(Butylated Hydroxy Toluene)是一种常用的食品抗氧化剂,下面是两种合成BHT的方法:下列说法正确的是( )
BHT(Butylated Hydroxy Toluene)是一种常用的食品抗氧化剂,下面是两种合成BHT的方法:下列说法正确的是( )| A. | 方法一和方法二的反应类型分别是取代和加成反应 | |
| B. |  与BHT互为同系物 与BHT互为同系物 | |
| C. |  能与Na2CO3溶液反应生成CO2 能与Na2CO3溶液反应生成CO2 | |
| D. | 1molBHT可与含有2molBr2的浓溴水发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
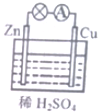
| A. | 原电池的反应本质是氧化还原反应 | B. | 电子由Cu片通过导线流向锌片 | ||
| C. | 正极反应式为Zn-2e=Zn2+ | D. | Cu为负极,Zn为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 原电池是把化学能转化为电能的装置,请回答下列问题:
原电池是把化学能转化为电能的装置,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液作导电试验,灯光较暗 | |
| B. | 醋酸(CH3COOH)是共价化合物 | |
| C. | 醋酸不与氯化钠反应 | |
| D. | 常温下1mol.L-1醋酸溶液的c(H+)约为0.004mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染” | |
| B. | 某些铝硅酸盐形成的分子筛中有许多笼状空穴和通道,常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体等 | |
| C. | pH计也可用于酸碱中和滴定终点的判断 | |
| D. | 海水中蕴含的元素有80多种,其中Mg、Br、I在海水中的总储量分别约为1.8×1015t、1×1014t、8×1010t.由于海水中镁的储量很大,工业上常以海水为原料提取镁,因此,镁元素被称为“海洋元素” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com