
| A. | 加入AgNO3溶液,有白色沉淀生成,证明含有Cl- | |
| B. | 加入BaCl2溶液,产生白色沉淀,证明有SO42- | |
| C. | 加入盐酸,放出能使澄清石灰水变浑浊的气体,证明有CO32- | |
| D. | 加浓NaOH溶液后加热,产生使湿润的红色石蕊试纸变蓝色的气体,证明有NH4+ |
分析 A.加入硝酸银溶液,银离子结合氯离子生成白色沉淀氯化银,硫酸根离子结合银离子也会出现白色沉淀;
B.加入氯化钡溶液,白色沉淀可能是氯化银沉淀或硫酸钡沉淀;
C.二氧化碳、二氧化硫,通入澄清石灰水都会变浑浊;
D.溶液中加入氢氧化钠溶液生成使湿润的红色石蕊试纸变蓝色的气体为氨气.
解答 解:A.加入硝酸银溶液,有白色沉淀生成,可能是银离子结合氯离子生成白色沉淀氯化银,也可能是硫酸根离子结合银离子生成的硫酸银白色沉淀,检验氯离子的方法是加入硝酸酸化的硝酸银有白色沉淀证明,故A错误;
B.加入氯化钡溶液,溶液中生成的白色沉淀可能是溶液中的氯离子生成的氯化银沉淀或溶液中硫酸根离子生成的硫酸钡沉淀,不能确定一定含氯离子,故B错误;
C.和盐酸反应生成气体可以是二氧化碳、二氧化硫,通入澄清石灰水都会变浑浊,加入盐酸,放出能使澄清石灰水变浑浊的气体,原溶液中可能是碳酸根离子、碳酸氢根离子、亚硫酸根离子、亚硫酸氢根离子,不能证明有CO32-,故C错误;
D.溶液中加入氢氧化钠溶液生成使湿润的红色石蕊试纸变蓝色的气体为氨气,证明溶液中含铵根离子,故D正确;
故选D.
点评 本题考查了离子检验的反应现象和试剂判断,注意干扰离子的分析,掌握基础是解题关键,题目难度中等


 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:选择题
| A. | 三种微粒所含有的电子数相等 | B. | 三种微粒中氮原子的杂化方式相同 | ||
| C. | 三种微粒的空间构型相同 | D. | 键角大小关系:NH4+>NH3>NH2- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{a}^{b}$R | B. | ${\;}_{a}^{a+b}$R | C. | ${\;}_{a-m}^{a+b-m}$R | D. | ${\;}_{a+m}^{a+b+m}$R |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 整个过程共发生2个氧化还原反应 | |
| B. | 在该溶液中滴少量品红,品红褪色 | |
| C. | 所有离子的浓度都发生了变化 | |
| D. | 反应过程中氯气既作氧化剂又作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 通CO的一极是电池的负极 | |
| B. | 负极发生的电极反应是:O2+2CO2+4e-═2CO32- | |
| C. | 正极发生的电极反应是:CO+CO32--2e-═2CO2 | |
| D. | 正极发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
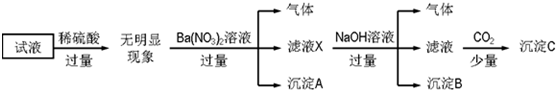
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com