
【题目】某可逆反应平衡常数表达式为K=![]() 达到平衡状态时,如果升高温度(其它条件不变),则c(NO)减小.下列说法正确的是( )
达到平衡状态时,如果升高温度(其它条件不变),则c(NO)减小.下列说法正确的是( )
A. 反应的热化学方程式为NO2(g)+SO2(g) ![]() NO(g)(g)+SO3(g) △H>0
NO(g)(g)+SO3(g) △H>0
B. 一定条件下达到平衡时,缩小容器体积,增大体系压强,气体颜色加深
C. 混合气体的平均摩尔质量保持不变,说明反应已达平衡
D. 使用合适的催化剂可使该反应的反应速率和平衡常数增大
科目:高中化学 来源: 题型:
【题目】下列对各组物质性质的比较中,正确的是
A. 硬度:Li>Na>K
B. 熔点:NaCl>CaO
C. 电负性:Na<Al<Mg
D. 空间利用率:体心立方堆积<六方堆积<面心立方堆积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是清洁的能源,也是重要的化工原料。
(1)以H2为原料制取氨气进而合成CO(NH2)2的反应如下:
N2(g)+3H2(g)+CO2(g)===CO(NH2)2(s)+H2O(l) ΔH=179.38 kJ·mol1
已知: 2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=159.47 kJ·mol1
NH2CO2NH4(s) ===CO(NH2)2(s)+H2O(l) ΔH=+72.49 kJ·mol1
则N2(g)+3H2(g) ===2NH3(g) ΔH= kJ·mol1。
(2)储氢材料领域是当前研究热点,LiBH4是一种良好的储氢材料。采用球磨法制备Al与LiBH4的复合材料,并对AlLiBH4体系与水反应产氢的特性进行下列研究:
①图甲为25℃水浴时每克不同配比的AlLiBH4复合材料与水反应产生H2体积随时间变化关系图。由图可知,下列说法正确的 (填字母)。
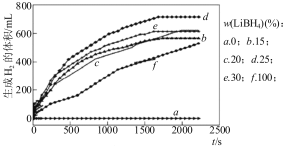

甲 乙
a.25℃时,纯LiBH4和铝均与水反应产生氢气
b.25℃时,复合材料中铝不能产生氢气,只是起到催化作用
c.25℃时,AlLiBH4复合材料中LiBH4含量25%,储氢效果最好
②图乙为25℃和75℃时,AlLiBH4复合材料[ω(LiBH4)=25%]与水反应一定时间后产物的X射线衍射图谱(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。从图分析,25℃时AlLiBH4复合材料中LiBH4与水反应生成的LiB(OH)4化学方程式为 ,铝元素的存在有多种形式,其中Al(OH)3产生的原因可能是 。
(3)已知H2S高温热分解制H2的反应为:H2S(g)![]() H2(g)+1/2S2(g)在恒容密闭容器中,控制不同温度进行H2S的分解实验,以H2S的起始浓度均为c mol·L1测定H2S的转化率,结果如下图所示:
H2(g)+1/2S2(g)在恒容密闭容器中,控制不同温度进行H2S的分解实验,以H2S的起始浓度均为c mol·L1测定H2S的转化率,结果如下图所示:

图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(S2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。
(4)用惰性电极电解煤浆液的方法制H2的反应为:C(s)+2H2O(l) ===CO2(g)+2H2(g)现将一定量的1 mol·L1 H2SO4溶液和适量煤粉充分混合,制成含碳量为0.02 g·mL1~0.12g·mL1的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极)。则B极的电极反应式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.常温下,HNO2电离反应的平衡常数值为2.6×10-4。NaNO2是一种重要的食品添加剂,由于其外观及味道都与食盐非常相似,误食工业用盐造成食物中毒的事件时有发生。
(1)某活动小组同学设计实验方案鉴别 NaCl溶液和NaNO2溶液,请填写下列表格。
选用药品 | 实验现象 | 利用NaNO2的性质 |
①酚酞试液 | ____________ | ____________ |
②淀粉-KI试纸 | ____________ | ____________ |
(2)亚硝酸钠有毒,不能随意排放,实验室一般将其与饱和氯化铵溶液共热使之转化成无毒无公害的物质,其产物之一为无色无味气体,则该气体为____________(填化学式)。
II.活动小组同学采用如下装置制备并测定所得固体中亚硝酸钠(NaNO2)的质量分数(装置可重复使用,部分夹持仪器已省略)。

已知: ①2NO + Na2O2 =2NaNO2;
②酸性条件下,NO、NO2都能与MnO4-反应生成NO3-和Mn2+;NaNO2能使
酸性高锰酸钾溶液褪色。
(1)实验装置的连接顺序为____________;
(2)C瓶内发生反应的离子方程式为____________。
(3)为了测定亚硝酸钠的含量,称取4.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.10 mol·L-1的酸性KMnO4溶液进行滴定,实验所得数据如下表。
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
①第一组实验数据出现较明显异常,造成异常的原因可能是__________(填字母序号)。
a.酸式滴定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶用蒸馏水洗净后未干燥
c.观察滴定终点时仰视读数
②根据表中数据进行计算,所制得的固体中亚硝酸钠的质量分数为____________。
(4)设计实验,比较0.1mol·L-1NaNO2溶液中NO2-的水解程度和0.1mol·L-1HNO2溶液中HNO2电离程度的相对大小_______(简要说明实验步骤、现象和结论,仪器和药品自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 可利用厨房中的食醋除去热水瓶水垢中的CaCO3:CaCO3+2H+=Ca2++CO2↑+H2O
B. 往酸性碘化钾溶液中滴加适量的双氧水:2I-+2H++H2O2=I2+2H2O
C. 往NH4HCO3溶液中加过量的NaOH溶液并加热: NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D. 金属钠和水反应:Na+H2O=Na++OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把温度为20℃,浓度为1.0mol·L-1的H2SO4和2.2mol·L-1的碱溶液各50ml混合(溶液密度均为1g·ml-1,比热容为4.184kJ·K-1·kg-1),轻轻搅动。测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1℃ | 终止温度t2℃ |
H2SO4+NaOH | 20 | 33.6 |
H2SO4+NH3·H2O | 20 | 32.6 |
则反应NH3·H2O (l)![]() NH4+(aq)+OH-(aq)的焓变约为(单位:kJ·mol-1) ( )
NH4+(aq)+OH-(aq)的焓变约为(单位:kJ·mol-1) ( )
A. +2.1 B. +4.2 C. +52.7 D. 缺少数据无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某烃A的分子组成和结构,对这种烃进行以下实验:
①取一定量的该烃,使其充分燃烧后的气体通过干燥管,干燥管增重7.2g;再通过石灰水,石灰水增重17.6g。
②经测定,该烃(气体)在标准状况下的密度为1.25g·L-1。
现以A为主要原料合成乙酸乙酯,其合成路线如图1所示.

(1)A分子中官能团的名称是___________,0.1mol该烃A能与_______g溴发生加成反应;加成产物需_______mol溴蒸气完全取代。B中官能团的名称是________________;
(2)写出C的结构简式_______________;
(3)反应②的化学方程式是______________________________;
反应④的化学方程式是______________________________;
(4)E是常见的高分子材料,合成E的化学方程式是__________________________。
(5)某同学用如图2所示的实验装置制取少量乙酸乙酯.实验结束后,试管甲中上层为透明的、不溶于水的油状液体.
①实验开始时,试管甲中的导管不伸入液面下的原因是_______________;
②上述实验中饱和碳酸钠溶液的作用是(填字母)_____________;
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
③在实验室利用B和D制备乙酸乙酯的实验中,若用1mol B和1mol D充分反应,不能生成1mol 乙酸乙酯,原因是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于硝酸的叙述正确的是( )
A. NO2溶于水生成硝酸,所以NO2是酸性氧化物
B. 硝酸可与活泼金属反应生成盐和氢气
C. 浓硝酸显黄色是因为含有NO2
D. 硝酸与木炭的反应既表现出氧化性又表现出酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国化学家伊夫·肖万获2005年诺贝尔化学奖。他发现了烯烃里的碳-碳双键会被拆散、重组,形成新分子,这种过程被命名为烯烃复分解反应 。烯烃复分解反应可形象地描述为交换舞伴。(如图所示)
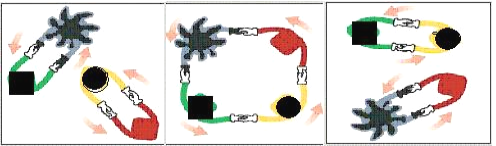
烯烃复分解反应中的催化剂是金属卡宾(如CH2==M),金属卡宾与烯烃分子相遇后,两对舞伴会暂时组合起来,手拉手跳起四人舞蹈。随后它们“交换舞伴”,组合成两个新分子,其中一个是新的烯烃分子,另一个是金属原子和它的新舞伴。后者会继续寻找下一个烯烃分子,再次“交换舞伴”。把C6H5CH2CH==CH2与CH2==M在一定条件下混合反应,下列产物不可能存在的是
A. C6H5CH2 CH2 C6H5 B. CH2= CH2
C. C6H5CH2CH==M D. C6H5CH2CH==CH CH2 C6H5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com