
| A. | 升高温度 | B. | 增大B的浓度 | ||
| C. | 增大压强 | D. | 使用合适的催化剂 |
科目:高中化学 来源: 题型:解答题

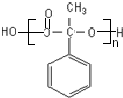 ;
;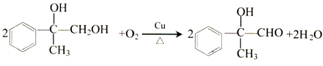 ,
,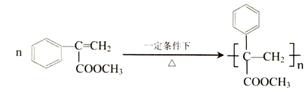 ;
; (写结构简式).
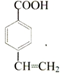
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成食品包装材料.
已知:A是来自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成食品包装材料.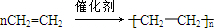 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.5mol•L-1 | B. | 5mol•L-1 | C. | 6mol•L-1 | D. | 8mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
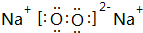 ,其中含有的化学键为离子键和共价键;
,其中含有的化学键为离子键和共价键;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z三种元素在周期表中处于同一周期 | |
| B. | 同主族元素中的X的气态氢化物最稳定 | |
| C. | 同一周期元素中Z的最高价氧化物对应的水化物酸性最强 | |
| D. | Y、Z所形成的化合物属于酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
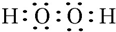 .W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)
.W、X、Y的离子半径由大到小的顺序为S2->O2->Al3+(用离子符号回答)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com