
| 1 |
| 23 |
| 1 |
| 24 |
| 1 |
| 27 |
| 1 |
| 23 |
| 1 |
| 2 |
| 1 |
| 24 |
| 1 |
| 27 |
| 3 |
| 2 |
| 1 |
| 23 |
| 1 |
| 12 |
| 1 |
| 9 |
| 1 |
| 23 |
| 1 |
| 12 |
| 1 |
| 9 |
| 22 |
| 23 |
| 11 |
| 12 |
| 8 |
| 9 |
| 1 |
| 23 |
| 1 |
| 12 |
| 1 |
| 9 |
| 22 |
| 23 |
| 11 |
| 12 |
| 8 |
| 9 |
| 23 |
| 22 |
| 12 |
| 11 |
| 9 |
| 8 |
| 23 |
| 22 |
| 12 |
| 11 |
| 9 |
| 8 |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
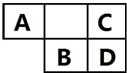 A��B��C��DΪ������Ԫ�أ������ڱ���������λ����ͼ��ʾ��A��C��Ԫ�ص�ԭ�Ӻ��������֮�͵���BԪ��ԭ�ӵ���������
A��B��C��DΪ������Ԫ�أ������ڱ���������λ����ͼ��ʾ��A��C��Ԫ�ص�ԭ�Ӻ��������֮�͵���BԪ��ԭ�ӵ����������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
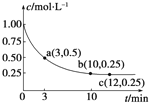 ��֪���淴ӦX��g��+2Y��g��?Z��g����H��0��һ���¶��£������Ϊ2L���ܱ������м���4mol Y��һ������X��X��Ũ����ʱ��ı仯�����ͼ��ʾ��������˵����ȷ���ǣ�������
��֪���淴ӦX��g��+2Y��g��?Z��g����H��0��һ���¶��£������Ϊ2L���ܱ������м���4mol Y��һ������X��X��Ũ����ʱ��ı仯�����ͼ��ʾ��������˵����ȷ���ǣ�������| A��a������Ӧ���ʴ����淴Ӧ���� |
| B������X��Ũ�ȣ�X��ת�������� |
| C��������ѹǿ�㶨ʱ������˵����Ӧ�Ѵ�ƽ��״̬ |
| D�������¶Ⱥ��ܱ�������ѹǿ���䣬�ٳ���1 mol X��2 mol Y���ٴδﵽƽ��ʱn��Z��/n��X����ֵ���С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������ʵ���ʱCH4��C2H4ȼ�����ɵ�H2Oһ���� |
| B��������ʱC2H2ȼ�����ɵ�CO2��� |
| C�������ʵ���ʱC2H2ȼ�պ������� |
| D��������ʱCH4ȼ�պ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����֪�����ȼ����Ϊ890.3kJ?mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪCH4��g��+2O2��g���T2CO2��g��+2H2O��g����H=-890.3kJ?mol-1 |
| B����֪C��ʯī��s���TC�����ʯ��s����H��0������ʯ��ʯī�ȶ� |
| C����֪S��g��+O2��g���TSO2��g����H1��S��s��+O2��g���TSO2��g����H2�����H1����H2 |
| D����֪�к���Ϊ��H=-57.4kJ?mol-1����1molϡ���������ϡNaOH��Һ��Ӧ�ķ�Ӧ�Ⱦ����к��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��H2O |
| B����ʾ�����ָ��� |
| C������I |
| D��ɳ���е�У |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com