
【题目】下列对热化学方程式![]() H2(g)+
H2(g)+![]() I2(g)══HI(g) ΔΗ=+26 kJ·mol-1的叙述中,正确的是
I2(g)══HI(g) ΔΗ=+26 kJ·mol-1的叙述中,正确的是
A.1 mol氢气和1 mol碘蒸气完全反应需要吸收26 kJ的热量
B.1个氢分子和1个碘分子完全反应需要吸收52 kJ的热量
C.1 mol H2(g)与1 mol I2(g)完全反应生成2 mol的HI气体需吸收52 kJ的热量
D.![]() mol H2(g)与
mol H2(g)与![]() mol I2(g)完全反应放出26 kJ的热量
mol I2(g)完全反应放出26 kJ的热量
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】等电子体之间具有相似的结构和化学键类型。根据等电子原理,由短周期元素组成的粒子,只要其原子总数和原子最外层电子总数相同,均可互称为等电子体.下列各组粒子不能互称为等电子体的是
A.CO32-和NO3- B.O3和SO2
C.CO2和NO2- D.SCN-和N3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中产生的SO2、NO直接排放将对大气造成严重污染.利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).
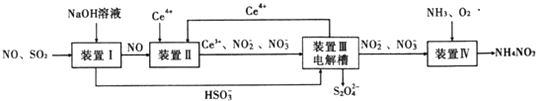
请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式__________________;
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示

①下列说法正确的是 (填标号)。
A.pH=7时,溶液中c( Na+)<c (HSO3-)+c(SO32-)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7
C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜
D.pH=9时溶液中c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3)
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的总离子方程式为 。
③取装置Ⅰ中的吸收液vmL,用cmol/L的酸性高锰酸钾溶液滴定。酸性高锰酸钾溶液应装在 (填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是 。
(3)装置Ⅲ 的作用之一是再生Ce4+ ,其原理如下图所示。

图中A为电源的 (填“正”或“负”)极。右侧反应室中发生的主要电极反应式为 。
(4) 已知进入装置Ⅳ的溶液中NO-2的浓度为 0.4 mol/L ,要使 1m3该溶液中的NO-2完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,水达到电离平衡时c(H+)与c(OH-)的关系如图所示,下列说法中正确的是

A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液等体积混合时恰好中和,所得溶液的pH等于7
B.25℃时,0.2mol/L Ba(OH)2 溶液和0.2 mol/L HC1溶液等体积混合,所得溶液的pH等于7
C.25℃时,0.2 mol/L NaOH溶液与 0.2 mol/L醋酸等体积混合后恰好中和,所得溶液pH大于7
D.25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液的pH小于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1个硫原子的质童是a g,l个l2C原子的质童是bg,用NA表示阿伏加德罗常数的值,则下列说法中正确的是( )
①该硫原子的相对原子质量为![]() ;
;
②m g该硫原子的物质的量为![]() mol
mol
③该硫原子的摩尔质量是aNAg
④a g该硫原子所含的电子数为16NA
A. ①③ B. ②④ C. ①② D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8。试回答下列问题:
(1)混合溶液pH=8的原因是 (用离子方程式表示)
(2)混合溶液中由水电离出的c(OH-) (填“大于”、“等于”或“小于”)0.1mol/LNaOH溶液中由水电离出的c(OH-)
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Na+)- c(A-)= mol/L, c(OH-)- c(HA)= mol/L
(4)常温下,将PH=2的酸HA溶液与PH=12的NaOH溶液等体积混合后,所得溶液PH 7 (填“大于”、“等于”或“小于”)
(5)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的PH 7(填“大于”、“等于”或“小于”);将同温度下等浓度的下列四种盐溶液按PH由大到小的顺序排列是 (填序号)
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
三硫化四磷是黄绿色针状结晶,其结构如图所示.不溶于冷水,溶于叠氮酸、二硫化碳、苯等有机济剂,在沸腾的NaOH稀溶液中会迅速水解。回答下列问题:

(1)Se是S的下一周期同主族元素,其核外电子排布式为_______。
(2)第一电离能:S____(填“>”或“<”,下同)P,电负性:S____P
(3)三硫化四磷分子中P原子采取______杂化,与PO3-互为等电子体的化合物分子的化学式为______。
(4)二硫化碳属______(填“极性”或“非极性”)分子。
(5)用NA表示阿伏伽德罗常数的数值,0.1mol三硫化四磷分子中含有的孤电子对数为____。
(6)纯叠氮酸(HN3)在常温下是一种液体,沸点较高,为308.8K,主要原因是________。
(7)氢氧化钠具有NaCl型结构,其晶胞中Na+与OH-之间的距离为acm ,晶胞中Na+的配位数为_______,用NA表示阿伏伽德罗常数的数值,NaOH的密度为_____g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期A、B、C、D四种元素,它们的原子序数依次增大,A元素形成的-2价阴离子比氦原子的核外电子数多8个;B元素与A元素可组成一种淡黄色固体E;C的最高价氧化物既可以与酸反应,也可以和碱反应;D元素原子的M层上有7个电子。
(1)C元素的名称 ________;D的气态氢化物与H2S相比,稳定性较强的是_______(用化学式表示);
(2)A、B、C、D三种元素形成的简单离子半径由大到小的顺序为___________________(用化学式表示);
(3)A的常见氢化物中有两种,其中含有18个电子的分子的电子式为是______________。
(4)用电子式表示化合物B2A的形成过程__________________________。
(5)钾元素与B元素位于同一主族,钾元素与A元素可形成K2A、K2A2、KA2等多种化合物,其中K2A2和KA2和CO2均可发生反应(反应与淡黄色固体E和CO2的反应类似),写出K2A2与CO2发生反应的化学方程式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、X、Y、Z的原子序数依次增大, a、b、c、d是这4种元素的单质(a、b、c、d顺序不与R、X、Y、Z对应),a为生活中常见的金属,厨房中常见a金属合金餐具和器具。在甲的溶液中通入丙气体,产生白色沉淀,它们之间转化关系如图所示。
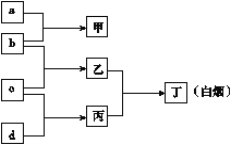
回答下列问题:
(1)写出Z元素在元素周期表中的位置______________________;
(2)写出物质丙的电子式__________________;
(3)X、Y、Z元素简单离子的半径由大到小排列的顺序为(用离子符号表示)______________;
(4)写出Y元素的氢氧化物与NaOH溶液反应的离子方程式______________________________;
(5)As(砷)与X是同族元素,位于第四周期,请写出砷原子的原子结构示意图____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com