
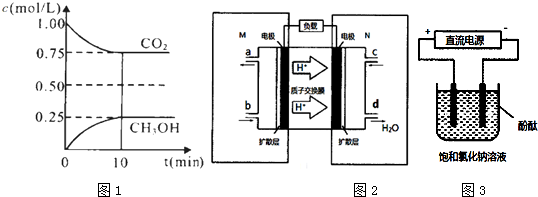
分析 (1)根据盖斯定律进行计算,书写热化学方程式;
(2)①化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断;
②根据图象数据结合平衡常数K的计算公式进行计算,根据K仅与温度有关及反应为放热来判断改变条件;
(3)①首先根据氢离子的移动方向来确定正负极,然后根据原电池原理书写电极反应式;
②整个电路中转移电子的数目相等,可以根据电子转移的数目相同来列出已知物质和未知物质之间关系式,然后通过关系来求解;
解答 解:(1)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-a kJ•mol-1;
②CH3OH(g)=CH3OH(l)△H=-b kJ•mol-1;
③2H2(g)+O2(g)=2H2O(g)△H=-c kJ•mol-1;
④H2O(g)=H2O(l)△H=-d kJ•mol-1,
由③×$\frac{3}{2}$+④×2-②-①得,CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l),△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l),△H=-($\frac{3}{2}$c+2d-a-b)kJ•mol-1.
(2)①CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
A.CO2的体积分数在混合气体中保持不变,则能说明达到平衡状态,故A正确;
B.平均相对分子质量=$\frac{总质量}{总物质的量}$,总质量一定,总物质的量会变,故混合气体的平均相对分子质量不随时间的变化而变化说明达到平衡状态,故B正确;
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O,不能体现正逆反应,故不能说明达到平衡状态,故C错误;
D.H2O与CH3OH都是产物,并且按照1:1的比例生成,所以H2O与CH3OH的物质的量浓度之比一直为1:1,不能说明达到平衡状态,故D错误;
故答案为:AB;
②由图象数据CO2(g)+3H2(g)?CH3OH(g)+H2O(g)得
开始浓度:1 1.5 0 0
转化浓度:0.25 0.75 0.25 0.25
平衡浓度:0.75 0.75 0.25 0.25
所以K=$\frac{0.25×0.25}{0.75×0.75{\;}^{3}}$=0.20,
平衡常数是温度的函数,只有通过改变温度,来改变平衡常数,正反应是放热反应,降低温度使平衡向正反应方向移动,K值变大,
故答案为:0.20;C;
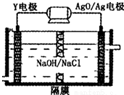
(3)①M区是质子流出的一极,应是原电池的负极,发生氧化反应,电极反应式为:CH3OH-6e-+H2O=CO2+6H+,
故答案为:CH3OH-6e-+H2O=CO2+6H+;
②用惰性电极,电解饱和食盐水总的电极反应式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-,
pH值变为13时,pOH=1,c(OH-)=0.1mol/L,n(OH-)=0.1mol/L×0.3L=0.03mol,由方程式CH3OH-6e-+H2O=CO2+6H+,2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-可知
CH3OH~6e-~6OH-
32g 6mol
m(CH3OH) 0.03mol
则m(CH3OH)=32g×0.03mol÷6mol=0.16g,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-;0.16g;
点评 本题考查化学平衡状态的判断、平衡常数的计算、化学平衡的影响因素、电极反应式和离子方程式的书写、以及盖斯定律的应用等知识,综合性强,难度较大.


科目:高中化学 来源: 题型:选择题
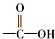 ”中的“-OH”被卤原子取代所得的化合物称为酰卤,下列化合物中可以看作酰卤的是( )
”中的“-OH”被卤原子取代所得的化合物称为酰卤,下列化合物中可以看作酰卤的是( )| A. | CHBr=CHCH3 | B. | CCl4 | C. | COCl2 | D. | CH2ClCOOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷 | B. | 乙烷 | C. | 丙烷 | D. | 丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
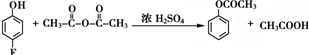 ;反应⑤的化学方程式为
;反应⑤的化学方程式为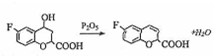 .
.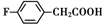 、
、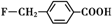 .
. 和乙酸酐为原料制备
和乙酸酐为原料制备 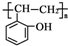 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素X、Y、Z、W原子序数依次增大,X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中,请回答:
短周期元素X、Y、Z、W原子序数依次增大,X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中,请回答: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 26g C2H2和苯蒸气的混合气体中所含的C原子数为2NA | |
| B. | 1mol甲基(-CH3)所含电子数为9NA | |
| C. | 标准状况下,B2H6和C2H4的混合气体22.4L,所含的电子数约为16NA | |
| D. | 标准状况下,1L庚烷所含有的分子数为NA/22.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | |
| B. | M与T形成的化合物具有两性 | |
| C. | 氢化物的稳定性为H2T<H2R | |
| D. | 单质与浓度相等的稀盐酸反应的速率为Q>L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com