
【题目】根据所学知识完成题目:
(1)下列物质含有离子键的是
A.H2
B.CO2
C.NH3
D.NaOH
(2)下列物质中含有共价键的离子化合物是
A.H2O
B.CaCl2
C.NH4Cl
D.HCl
(3)NaCl、NH3的电子式 .
【答案】
(1)D
(2)C
(3)![]()
【解析】解:(1)N2属于单质分子,分子中只有共价键;CO2、NH3分子中只有共价键;NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键,所以答案是:D;(2)A.H2O中只含共价键,为共价化合物,故A错误;B.CaCl2中只含离子键,不含共价键,属于离子化合物,故B错误;C.NH4Cl中铵根离子和氯离子之间存在离子键,氮原子和氢原子之间存在共价键,氯离子中氮原子和氧原子之间存在共价键,故C正确;D.HCl中只含共价键,为共价化合物,故D错误.所以答案是:C;(3)氯化钠是离子化合物,是钠离子和氯离子通过静电作用形成的,其电子式为 ![]() ;氨气为共价化合物,分子中存在3对共用电子对,氮原子最外层达到8个电子,氢原子最外层达到2个电子,氨气分子的电子式为
;氨气为共价化合物,分子中存在3对共用电子对,氮原子最外层达到8个电子,氢原子最外层达到2个电子,氨气分子的电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;
; ![]() .
.
【考点精析】本题主要考查了离子键的相关知识点,需要掌握成键元素:活泼金属(或NH4+)与活泼的非金属(或酸根,OH-);静电作用:指静电吸引和静电排斥的平衡才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】根据下面两个方程式选出正确项( ) 已知:①2CO(g)+O2(g)═2CO2(g)△H=﹣566kJmol﹣1
②Na2O2(s)+CO2(g)═Na2CO3(s)+ ![]() O2(g)△H=﹣226kJmol﹣1
O2(g)△H=﹣226kJmol﹣1
A.CO的燃烧热为566kJmol﹣1
B.如图可表示①反应过程中的能量变化
C.Na2O2(s)+CO(g)═Na2CO3(s)△H=﹣509kJmol﹣1
D.由②可知,反应生成Na2CO3固体106g,放出热量226kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是未来最理想的能源.科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O ![]() 2H2↑+O2↑.制得的氢气可用于燃料电池.试回答下列问题:
2H2↑+O2↑.制得的氢气可用于燃料电池.试回答下列问题:
(1)分解海水时,实现了从光能转化为能.生成的氢气用于燃料电池时,实现了化学能转化为能.分解海水的反应属于反应(填“放热”或“吸热”).
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,A、B两极上发生的电极反应分别为 A极:2H2+2O2﹣﹣4e﹣═2H2O,则A极是电池的极,电子从该极(填“流入”或“流出”).B极电极反应式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2作为重要的燃料和化工原料,有着十分广泛的应用.
(1)已知:C(s)+O2(g)=CO2(g)△H1=﹣393.5kJmol﹣1C(s)+H2O(g)=CO(g)+H2(g)△H2=+131.3kJmol﹣1
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H=kJmol﹣1 .
(2)利用反应CO(g)+H2(g)+O2(g)=CO2(g)+H2O(g)设计而成的MCFS燃料电池是用水煤气(CO和H2物质的量之比为1:1)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质的一种新型电池.现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置以及现象如图所示.则有:
①燃料电池即电源的N极的电极反应式为;
②已知饱和食盐水的体积为1L,一段时间后,测得左侧试管中气体体积为11.2mL(标准状况),若电解前后溶液的体积变化忽略不计,而且电解后将溶液混合均匀,则此时溶液的pH为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行的实验,能达到相应实验目的是( ) 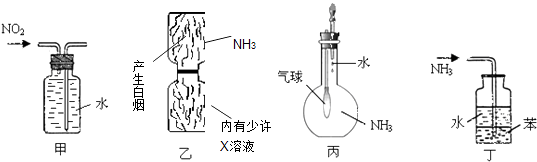
A.装置甲:收集NO2气体
B.装置乙:验证X溶液为浓硫酸
C.装置丙:验证氨气在水中的溶解性
D.装置丁:用于吸收尾气NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子浓度在指定溶液中一定能大量共存的是( ) ①加入铝能放出H2的溶液中:Al3+、Fe2+、Cl﹣、NO ![]() 、S2﹣
、S2﹣
②使pH=11的溶液中:Na+、NO ![]() 、SO
、SO ![]() 、AlO2﹣、S2﹣
、AlO2﹣、S2﹣
③由水电离出的c(H+)=10﹣12mol/L的溶液中:Na+、NO ![]() 、SO
、SO ![]() 、AlO2﹣、S2﹣
、AlO2﹣、S2﹣
④能使淀粉碘化钾试纸显蓝色的溶液:K+、SO ![]() 、SO
、SO ![]() 、S2﹣、OH﹣
、S2﹣、OH﹣
⑤使甲基橙变红的溶液中:Fe3+、NH4+、Cl﹣、K+、SO42﹣ .
A.③④
B.②④
C.②⑤
D.①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利尿酸在奥运会上被禁用,其结构简式如下图所示。下列叙述正确的是( )

A. 利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4
B. 利尿酸分子内处于同一平面的原子不超过10个
C. 1 mol利尿酸能与7 mol H2发生加成反应
D. 利尿酸能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在由NaOH、Na2O2组成的混合物中钠元素的质量分数为58%,则混合物中氢元素的质量分数为( )
A. 62% B. 2% C. 4% D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇合成反应及其能量变化如图a所示: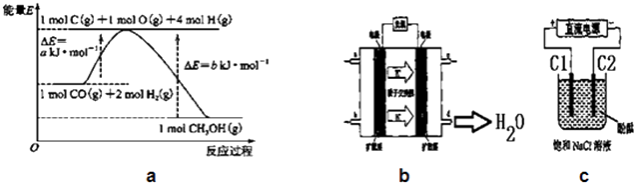
(1)写出合成甲醇的热化学方程式 .
(2)实验室在1L的密闭容器中进行模拟合成实验.将1mol CO和2molH2通入容器中,分别恒温在300℃和500℃反应,每隔一段时间测得容器内CH3OH的浓度如下表所示:
时间浓度(mol/L)温度 | 10min | 20min | 30min | 40min | 50min | 60min |
300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
在300℃反应开始10min内,H2的平均反应速率为v(H2)= .
(3)在500℃达到平衡时,平衡常数K= .
(4)在另一体积不变的密闭容器中,充入1.2mol CO和2.0mol H2 , 一定条件下达到平衡,测得容器中压强为起始压强的一半.计算该条件下H2的转化率为 .
(5)铜基催化剂具有活性高、选择性好和条件温和的特点,已广泛地使用于CO/CO2的加氢合成甲醇.使用铜基催化剂后,该反应中a的大小变化对反应热△H有无影响, . (填“有影响”或“无影响”)
(6)2009年,长春应用化学研究所在甲醇燃料电池技术上获得新突破,原理如图b所示.请写出从C口通入O2发生的电极反应式 .
(7)用上述电池做电源,用图c装置电解饱和食盐水(C1、C2均为石墨电极).①该反应的离子方程式 .
②电解开始后在电极的周围(填“C1”或“C2”)先出现红色.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com