
【题目】在一定条件下CO与CH4燃烧的热化学方程式分别为:2CO(g)+O2(g)→2CO2(g)+566kJ,CH4(g)+2O2(g)→2CO2(g)+2H2O(l)+890kJ,有76g甲烷与一氧化碳的混合气体在上述条件下充分燃烧,释放的能量为2953kJ,则混合气体的平均相对分子质量为多少?___
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)已知:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-115. 6 kJ·mol-1, H2(g)+Cl2(g)=
2Cl2(g)+2H2O(g) ΔH=-115. 6 kJ·mol-1, H2(g)+Cl2(g)=
2HCl(g)ΔH=-184 kJ·mol-1。
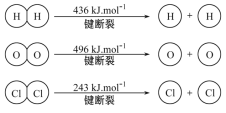
①H2与O2反应生成气态水的热化学方程式是___________。
②断开1 mol H—O键所需能量为______ kJ。
③高温下H2O可分解生成分子或原子。高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是________,物质的量之比为2:1的A、H2化学能较低的物质是________。

(2)已知ΔG=ΔH—T·ΔS。在100 kPa、298. 15 K时石灰石分解反应CaCO3(s)= CaO(s)+CO2(g)的ΔH=+178. 3 kJ·mol-1,ΔS=+160. 4 J·mol-1·K-1
①从吉布斯自由能变(ΔG)的角度说明该反应高温下能自发进行的原因___________________。
②则该反应自发进行的最低温度为__________K。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氰酸(HCN)是一种剧毒类弱酸,具有苦杏仁气味,将其加水不断稀释,下列各量始终保持增大的是
A. Ka(HCN) B. c(H+) C. c(CN-)/c(HCN) D. C(HCN)/ c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,生产原理为:Fe(NO3)3+NaOH+Cl2→Na2FeO4+NaNO3+NaCl+H2O
(1)配平并用单线桥法标出电子转移情况:___
___Fe(NO3)3+___NaOH+___Cl2→___Na2FeO4+___NaNO3+___NaCl+___H2O
(2)反应中的氧化剂是_____;还原产物是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写出下列化学方程式。
(1)氯气与石灰水的反应: _____________________
(2)铁丝在氯气中燃烧的反应: ____________________
(3)次氯酸见光分解的反应: ____________________
(4)钠与硫酸铜溶液反应: __________________ , __________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中共十九大报告指出,加快水污染防治、实施流域环境和近岸海域综合治理、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。在适当的条件下,将CO2转化为甲醇、甲醚等有机物,既可降低CO2造成的温室效应对环境的影响,还可得到重要的有机产物。
(1)已知T K时,某恒容密闭容器中存在如下反应:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
CH3OCH3(g)+3H2O(g) ΔH<0,测得容器中不同时刻时各物质的浓度(mol/L)如下表所示:
c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | |
开始时 | a | b | 0 | 0 |
10 s时 | 3 | 0.5 | c | 1.5 |
①若T K时,化学平衡常数K=15,则10 s 时v(正)_______v(逆)(填“>”“<”或“=”),此时CO2的转化率为________。
②既能提高反应速率,又能提高H2转化率的方法是___________(填序号)。
A.加入过量CO2气体 B.升高温度 C.适当压缩容器体积 D. 将CH3OCH3(g) 分离出去
(2)一定条件下,向某恒容密闭容器中充入x mol CO2和y mol H2,发生的反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。
CH3OH(g)+H2O(g) ΔH=50 kJ·mol1。
①下图1中能表示该反应的平衡常数K与温度T之间的变化关系曲线为______(填“a”或“b”),其判断依据是__________________________________。

②若x=2、y=3,测得在相同时间内不同温度下H2的转化率如图2所示,则在该时间段内,恰好达到化学平衡时,容器内的压强与反应开始时的压强之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类研究的重要课题,目前工业合成氨的原理为:N2(g) + 3H2(g) ![]() 2NH3(g) ΔH=-93.0kJ/mol
2NH3(g) ΔH=-93.0kJ/mol
(1)某温度下,在2 L密闭容器中发生上述反应,测得数据如下:
时间/h 物质的量/mol | 0 | 1 | 2 | 3 | 4 |
N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
①0~2 h内,v(N2)=____________。
②平衡时,H2的转化率为______;
该温度下,反应2NH3(g)![]() N2(g) + 3H2(g) 的平衡常数K=_______ (mol/L)2。
N2(g) + 3H2(g) 的平衡常数K=_______ (mol/L)2。
③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3的浓度与上表中相同的为_______(填选项字母)。
A.a=l、b=3、c=0 B.a=4、b=12、c=0
C.a=0、b=0、c=4 D.a=l、b=3、c=2
(2)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热ΔH=-286.0kJ/mol,则用N2与水反应制NH3的热化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于常温下pH为2的硫酸,下列叙述正确的是
A. c(H+)=c(SO42-)+c(OH-)
B. 与等体积pH=12的氨水混合后所得溶液显酸性
C. 由H2O电离出的c(H+)=1.0×10-12 mol·L-1
D. 与等体积0.01 mol·L-1的乙酸钠溶液混合后所得溶液中:c(SO42-)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是( )

A. 该硫酸的物质的量浓度为9.2mol/L
B. 盛放该试剂的包装上应标出图 所示的危险化学品标志
所示的危险化学品标志
C. 配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL
D. 该硫酸与等体积的水混合所得溶液的质量分数小于49%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com