
| A. | 10 | B. | 11 | C. | 13 | D. | 15 |
分析 碳原子要达到8电子稳定结构应该形成4个共价键,氮原子要形成8电子稳定状态应该形成3个共价键,氢原子形成2电子稳定状态应该形成1个共价键,据此分析解答.
解答 解:假设碳原子连接氮原子,氮原子在边上为氨基,氨基含有2个氢原子,剩余的碳原子和氢原子形成烷基或烯烃基,如果形成的是烷基,则x=2+2×5+1=13,如果形成的是烯烃基,x=2+2×5-1=11,碳和氢原子还可以形成炔烃基,氢原子个数更少x=2+2×5-3=9,所以BC符合,
故选BC.
点评 本题考查C、N成键数,注意碳原子要达到8电子稳定结构应该形成4个共价键,氮原子要形成8电子稳定状态应该形成3个共价键为解答关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
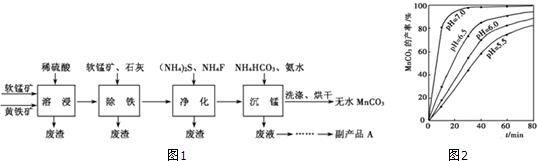
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
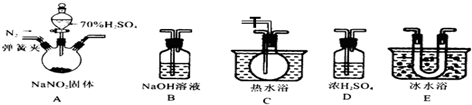
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一原子中,形状相同的原子轨道(即能级)的能量相同 | |
| B. | 同一原子中的2p能级上 的电子的运动状态完全相同 | |
| C. | 多电子原子中,核外电子的运动遵循能量最低原理 | |
| D. | 多电子原子中,每个能层(即电子层)上电子的能量一定不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
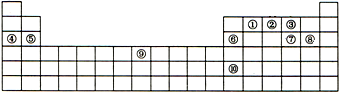 下表是元素周期表的一部分,表中每一序号分别代表一种元素.
下表是元素周期表的一部分,表中每一序号分别代表一种元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol Na完全被氧化生成Na2O2时,转移电子的数目为0.5NA | |
| B. | 0.1molO3中所含氧原子数目为0.2NA | |
| C. | 0.1mol•L-1的NaF溶液中所含F-的数目小于0.1NA | |
| D. | 标准状况下,2.24L CCl4中含有的C-Cl数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,在水中的溶解度:丙三醇>苯酚>1-氯丁烷 | |
| B. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| C. | 用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 | |
| D. | 油脂在酸性或碱性条件下均能发生水解反应,且产物相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com