
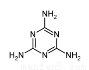
三聚氰胺俗称“蛋白精”,工业上通过下列流程合成三聚氰胺。请回答下列问题:
(1)基态Ca原子的电子排布式:___________________;CaC2的电子式________________。
(2)尿素分子中所含除氢以外元素第一电离能由小到大的顺序为________________。
(3)CaCN2中阴离子为CN22-,与CN22-互为等电子体的分子有N2O和________(填化学式),由此可以推知CN22-的空间构型为________。
(4)三聚氰胺分子中碳原子的杂化方式为________,分子中处于同一平面的氮原子有_____个。
(5)动物摄入三聚氰胺和三聚氰酸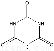 后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
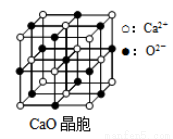
(6)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为______________,已知CaO晶体的密度为ρ,用NA表示阿伏伽德罗常数,求晶胞中距离最近的两个钙离子之间的距离__________(用含ρ、NA代数式表示)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年四川省乐山市高二上学期期末化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列叙述错误的是
A.1.8g18O2分子与1.8g18O3分子中含有的中子数不同
B.7.8gNa2S和7.8g Na2O2中含有的阴离子数目均为0.1NA
C.23.4 g NaCl晶体中含有0.1NA个如图所示的结构单元
D.含16 g氧原子的二氧化硅晶体中含有的δ键数目为2NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省广安市高一上学期期末化学试卷(解析版) 题型:推断题
已知A为淡黄色固体,R是地壳中含量最多的金属元素的单质,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C、F是无色无味的气体,H是白色沉淀,W溶液中滴加KSCN溶液出现红色。

(1)物质D的化学式为___________,E化学式为___________;
(2)点燃气体F前必须先_________________________;
(3)H在潮湿空气中变成M的实验现象是_______________,化学方程式为_______________,其反应类型是 反应(填基本反应类型)。
(4)B和R在溶液中反应生成F的离子方 程式为____________________,该反应属 反应 (填基本反应类型)。
程式为____________________,该反应属 反应 (填基本反应类型)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省广安市高一上学期期末化学试卷(解析版) 题型:选择题
下列实验操作中错误的是
A. 蒸馏操作时,冷凝管中冷却水应低进高出
B. 萃取操作时,必须选择密度比水大的萃取剂
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D. 蒸发操作时,不能等到蒸发皿中水分完全蒸干后才停止加热
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省广安市高一上学期期末化学试卷(解析版) 题型:选择题
从化合价的角度判断,下列物质中的硫元素不能表现氧化性的是
A.H2S B.S C.Na2SO3 D.H2 SO4(浓)
SO4(浓)
查看答案和解析>>
科目:高中化学 来源:2017届吉林省高三上摸底考试四化学卷(解析版) 题型:选择题
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,其总反应为:2CH2=CH2+O2→2CH3CHO。下列有关说法正确的是
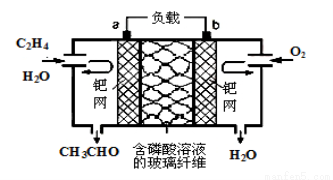
A.该装置能量转化形式是电能转化为化学能
B.负极反应式为:CH2=CH2-2e-+H2O=CH3CHO +2H+
C.每有0.1 mol O2反应,则向负极迁移的H+的物质的量为0.4 mol
D.电子移动方向:电极a→磷酸溶液→电极b
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三模拟一化学试卷(解析版) 题型:填空题
[化学——选修3:物质结构与性质]磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。回答下列问题:
(1)基态P原子的核外电子排布式为 ________,有________个未成对电子。
(2)磷的一种同素异形体——白磷(P4)的立体构型为________,其键角为__________,推测其在CS2中的溶解度________(填“大于”或“小于”)在水中的溶解度。
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6º和107º,试分析PH3的键角小于NH3的原因 ______________________________。
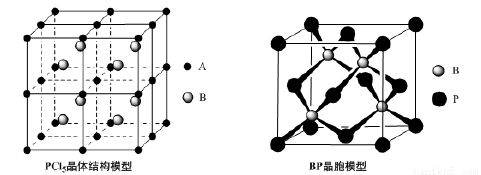
(4)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如上左图所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A、B两种微粒分别与CCl4、SF6互为等电子体,则A为______,其中心原子杂化轨道类型为__________,B为________。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,上右图为其立方晶胞,其中的每个原子均满足8电子稳定结构,试判断其熔点 __________(填“高于”或“低于”)金刚石熔点。
已知其B—P键长均为x cm,则其密度为 ________g﹒cm—3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省衡阳市高三上质检二化学卷(解析版) 题型:选择题
下列实验装置中能达到实验目的是
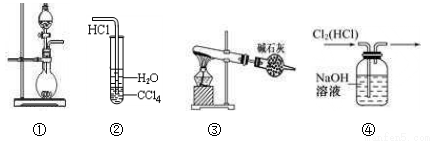
A. 图①可用于制取少量NH3或用MnO2和浓盐酸制取Cl2
B. 装置②可用于氯化氢气体溶于水
C. 以NH4Cl为原料,装置③可用于实验室制备少量干燥的NH3
D. 装置④可用于除去Cl2中的HCl
查看答案和解析>>
科目:高中化学 来源:2017届海南省高三上学期期末化学试卷(解析版) 题型:填空题
周期表中有A、B、C三种原子序数依次增大的元素,A是地壳中含量最多的金属元素,B的价层电子排布为nsn-1npn+1,C是生活中的一种常用金属且其原子的外围电子排布为3d104s1。
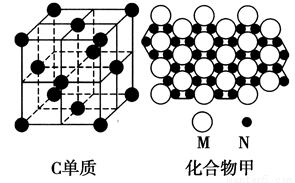
(1)A基态原子的电子排布式为__________________。
(2)一氧化碳(与N2互为等电子体)分子中σ键与π键数目之比为________。
(3)C的单质和某化合物甲的微观部分结构分别如图所示,C微粒周围等距离且距离最近的C微粒有________个;甲的化学式为________(用M、N表示)。
(4)金属C在加热时与B的最高价氧化物对应水化物的浓溶液反应的化学方程式为____________。
(5)C元素的最高价氧化物的水化物能溶于氨水,该反应的化学方程式为__________________。
(6)联氨(N2H4)是航天飞船常用的高能燃料,可以用尿素为原料制取,方法是在KMnO4催化剂存在下,尿素[CO(NH2)2]和次氯酸钠、NaOH溶液反应生成联氨、Na2CO3、H2O及另外一种产物,写出该反应的化学方程式:____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com