
分析 设溶液体积为1L,浓度均为c mol•L-1的硫酸和NaOH溶液等体积混合后,硫酸过量,根据NaOH的量来计算生成的硫酸钠的物质的量和浓度;而1mol硫酸钠中含2mol钠离子,据此分析钠离子的浓度;根据过量的硫酸来计算其物质的量浓度.
解答 解:设溶液体积为1L,则浓度均为c mol•L-1的硫酸和NaOH溶液的物质的量均为cmol,等体积混合后,硫酸过量,设反应掉的硫酸的物质的量为xmol,生成的硫酸钠为ymol,则有:
H2SO4 +2NaOH=Na2SO4 +2H2O
1 2 1 2
xmol cmol ymol
故有:$\frac{1}{x}=\frac{2}{c}=\frac{1}{y}$
解得x=$\frac{c}{2}$mol,y=$\frac{c}{2}$mol
故过量的硫酸的物质的量为$\frac{c}{2}$mol.
则的所得溶液中的硫酸钠的物质的量浓度为=$\frac{n}{V}$=$\frac{\frac{c}{2}mol}{2L}$=$\frac{c}{4}$mol/L.
而而1mol硫酸钠中含2mol钠离子,故溶液中的钠离子的浓度为$\frac{c}{2}$mol/L.
由于过量的硫酸的物质的量为$\frac{c}{2}$mol,故溶液中的硫酸的物质的量浓度为=$\frac{n}{V}$=$\frac{\frac{c}{2}mol}{2L}$=$\frac{c}{4}$mol/L.
故答案为:$\frac{c}{4}$mol/L;$\frac{c}{2}$mol/L;$\frac{c}{4}$mol/L.
点评 本题考查了根据化学方程式来进行的有关计算,难度不大,应先判断反应时哪种物质过量,然后根据计量数之比等于物质的量之比来计算.


科目:高中化学 来源: 题型:解答题
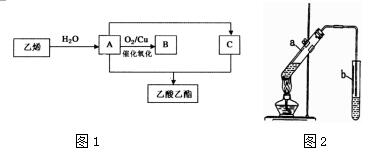
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸跟氢氧化镁反应:H++OH-═H2O | |
| B. | 碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+═Ca2++2H2O+2CO2↑ | |
| C. | 铁与氯化铁溶液反应:Fe+2Fe3+=3Fe2+ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某沿海城市技术开发公司研制的海水淡化膜--资源问题 | |
| B. | 用石灰法进行工业废气脱硫--污染问题 | |
| C. | 研制用纯净的二氧化硅做光导纤维--能源问题 | |
| D. | 中科院研制的新型钛合金用于航空航天--材料问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 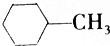 的一氯代物最多有4种 的一氯代物最多有4种 | |
| B. | 乙酸可与乙醇、金属钠、新制Cu(OH)2悬浊液等物质反应 | |
| C. | Cl2可与乙烷发生取代反应,与乙烯发生加成反应 | |
| D. | 阿托酸(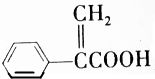 )可用于合成高分子材料 )可用于合成高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 向某种化学肥料中加入熟石灰混合、研磨 | 没有氨味 | 该化学肥料一定不是氮肥 |
| B | 点燃某种纤维材料 | 无烧焦羽毛的气味 | 该纤维一定是合成纤维 |
| C | 向一未知溶液中加入稀盐酸 | 有无色气泡产生 | 该溶液中一定含有CO32- |
| D | 向一未知溶液中先滴加足量稀盐酸,再滴加BaC12溶液 | 先无现象,后产生白色沉淀 | 原溶液中一定含有SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
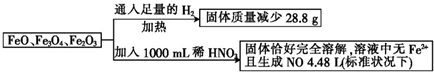
| A. | 4.0 mol•L-1 | B. | 4.4 mol•L-1 | C. | 4.8 mol•L-1 | D. | 3.6 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
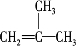 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com