
| A. | CnH2n | B. | CnH2n+2 | C. | CnH2n-2 | D. | CnH2n-6 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液 | B. | 氢氧化钠溶液 | C. | 氨水 | D. | 硝酸钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
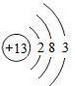
| 元素代号 | X | Y | Z | W | M | Q |
| 原子半径/nm | 0.037 | 0.074 | 0.099 | 0.186 | 0.102 | 0.143 |
| 主要化合价 | +1 | -2 | -1、+7 | +1 | -2、+6 | +3 |
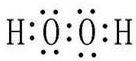 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图示实验室化学试剂浓硫酸标签上的部分内容.现需要490ml1.0moL•L-1H2SO4溶液.用该浓硫酸和蒸馏水配制,可供选用的仪器有:
如图示实验室化学试剂浓硫酸标签上的部分内容.现需要490ml1.0moL•L-1H2SO4溶液.用该浓硫酸和蒸馏水配制,可供选用的仪器有:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸性重铬酸钾溶液检验酒驾,是因为乙醇被还原 | |
| B. | 酸性高锰酸钾溶液和溴水都既能鉴别出甲烷和乙烯又能除去甲烷中含有的乙烯再经干燥而获得纯净的甲烷 | |
| C. | 石油中含有C5~C11的烷烃,可以通过分馏得到汽油 | |
| D. | 煤中含有苯和甲苯,可以用先干馏,后蒸馏的方法把它们分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3、O2 | B. | SO2、SO3 | C. | SO2、SO3、O2 | D. | SO2、O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能发生皂化反应 | B. | 都可以在稀硫酸中水解生成酸和醇 | ||
| C. | 都具有酯基 | D. | 油脂可用于生产肥皂和油漆 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
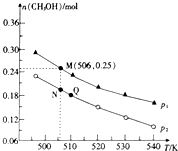 二氧化碳是常见的温室气体,其回收利用是环保领域研究的热点课题.回答下列问题:
二氧化碳是常见的温室气体,其回收利用是环保领域研究的热点课题.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O | B. | NaOH | C. | AgNO3 | D. | BaCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com