
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 2.54×10-1mg |
| 12.7×10-3kg |
| xmg |
| 1kg |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
A、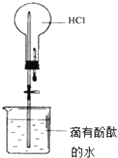 打开止水夹,烧瓶内出现红色喷泉 |
B、 酸性KMnO4溶液中出现气泡,颜色无明显变化 |
C、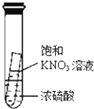 静置一段时间,小试管内有晶体析出 |
D、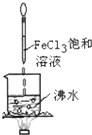 烧杯中液体变为红褐色后,继续加热煮沸,会出现浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
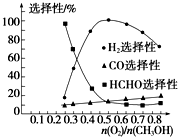
| n(O2) |
| n(CH3OH) |
| n(O2) |
| n(CH3OH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、铜
| ||||
B、铜
| ||||
C、铜
| ||||
D、铜
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、居室内空气中存在的污染物主要来自于装修材料、日用化学品、香烟烟雾以及家用燃料的燃烧产物等 |
| B、燃料不完全燃烧产生的一氧化碳也是一种室内污染物 |
| C、在居室内放置几盒花草就可消除室内空气污染 |
| D、预防装修污染,最重要的是选择经过严格检测的、环保的装修材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X与Y形成的化合物中,X可以显负价,Y显正价 |
| B、最高正化合价:X大于Y |
| C、第一电离能可能Y小于X |
| D、气态氢化物的稳定性:HmY小于HnX |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、mol/L |
| B、mol/L |
| C、2.5dmol/L |
| D、1.25dmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(C)=v(A)=0.2 mol?L-1?s-1 |
| B、z=3 |
| C、B的转化率为75% |
| D、反应前与2 s后容器的压强比为4:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com