
 如图中A~G是化合物,H是一种无色气态单质,D高温下是气体,而常温下是一种无色液体,E为淡黄色的固体.它们之间有如下转化关系:
如图中A~G是化合物,H是一种无色气态单质,D高温下是气体,而常温下是一种无色液体,E为淡黄色的固体.它们之间有如下转化关系:
| ||
| ||


科目:高中化学 来源: 题型:
| A、在密闭容器中加入1mol N2和3mol H2,充分反应生成NH3分子数为2NA |
| B、标准状况下,22.4L的CCl4分子中含有共价键数为4NA |
| C、常温常压下,1mol NaHSO4晶体中含有2NA个离子 |
| D、电解饱和食盐水,当阴极产生2.24L H2时,转移的电子数一定为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 |
| 溶度积 | 2.8×10-9 | 6.8×10-6 | 5.5×10-6 | 1.8×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
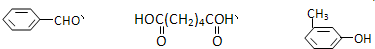
 互为同分异构体的是
互为同分异构体的是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 在如图所示的电解装置中:
在如图所示的电解装置中:查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:A、B、C、D、E、G、L七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;L原子核外最外层电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、G的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与G能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、G、L七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;L原子核外最外层电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、G的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与G能形成原子数目比为1:3、熔点为190℃的化合物Q.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将FeCl3溶液加热至沸腾,溶液由黄色变为红褐色 |
B、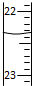 滴定达终点时,如图滴定管的正确读数为23.65 mL |
| C、向AgI悬浊液中滴加少量NaCl溶液,沉淀转化为白色 |
| D、测定溶液的pH时,应先将pH试纸润湿,然后进行检测 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com