
| A.①②③④ | B.⑤⑥⑦⑧ | C.③⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |
 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源:不详 题型:单选题
| A.若V1>V2,则说明HA的酸性比HB的酸性强 |
| B.若V1>V2,则说明HA的酸性比HB的酸性弱 |
| C.因为两种酸溶液的pH相等,故V1一定等于V2 |
| D.若将两种酸溶液等体积混合,混合酸溶液的pH一定等于2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 SO3(g)+NO(g)
SO3(g)+NO(g)
| A.反应物的总能量高于生成物的总能量 |
| B.反应物浓度:a点大于b点 |
| C.反应在c点达到平衡状态 |
| D.SO2的转化率:a点小于b点 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2O(g),反应过程中能量变化如图所示,则:
H2O(g),反应过程中能量变化如图所示,则:
 O2(g)=H2O(l) ΔH="-285.8" kJ·mol-1
O2(g)=H2O(l) ΔH="-285.8" kJ·mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.△H1=△H2 | B.△H1<△H2 | C.Q1 >2Q3 | D.△H1>2△H3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g) ΔH=-437.3 kJ?mol-1
CO2(g) ΔH=-437.3 kJ?mol-1 H2O(g) ΔH=-285.8 kJ?mol-1
H2O(g) ΔH=-285.8 kJ?mol-1 CO2(g) ΔH=-283.0 kJ?mol-1
CO2(g) ΔH=-283.0 kJ?mol-1 CO(g) + H2(g) ΔH= kJ?mol-1。如果该反应ΔS=+133.7 J·K-1·mol-1 该反应在常温(25 ℃)下能否自发进行?(△G=△H-T△S) (填“能”或“不能”,并写出判断依据).
CO(g) + H2(g) ΔH= kJ?mol-1。如果该反应ΔS=+133.7 J·K-1·mol-1 该反应在常温(25 ℃)下能否自发进行?(△G=△H-T△S) (填“能”或“不能”,并写出判断依据).| 化学键 | H-H | N-H | N≡N |
| 键能/kJ·mol-1 | 436 | 391 | 945 |
 2NH3 △H="a" kJ·mol-1。试根据表中所列键能数据估算a的数值为 。
2NH3 △H="a" kJ·mol-1。试根据表中所列键能数据估算a的数值为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 N2↑+ 4H2O+Cl2↑+2O2↑,放出热量为Q,下列对此反应叙述中错误的是( )
N2↑+ 4H2O+Cl2↑+2O2↑,放出热量为Q,下列对此反应叙述中错误的是( )| A.反应属于分解反应 |
| B.上述反应瞬间产生大量高温气体推动航天飞机飞行 |
| C.反应从能量变化上说,主要是化学能转变为热能和动能 |
| D.在反应中高氯酸铵只起氧化剂作用 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
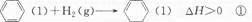
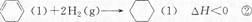
| A.反应①、②都属于加成反应 |
| B.在通常条件下,反应①、②都能自发进行 |
| C.反应①吸热、反应②放热的事实说明苯环中含有的并不是碳碳双键 |
| D.反应①、②中的所有有机物均可使溴水褪色,但褪色原理不完全相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com