(1)下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
①请写出图中b单质对应元素原子的电子排布式________________
②单质a、f对应的元素以1:1的原子个数比形成的分子(相同条件下对H2的相对密度为13)中含___个σ 键和___个π键。
③a与b元素形成的10电子中性分子X的空间构型为___________,将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到络合离子的化学式为__________,其中X与Ag+之间以__________键结合。
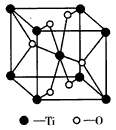
④下图是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:_____________________
(2)碳是形成化合物最多的元素,其单质与化合物广泛存在于自然界中。
①与碳同周期的非金属元素N的第一电离能大于O的第一电离能,原因是____________。
②CS2是一种重要的有机溶剂,写出一种与CS2互为等电子体的阴离子的化学式:____________。
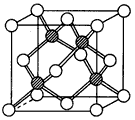
③冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如下图,所有球表示的微粒相同。其中空心球所示原子位于立方体的顶点或面心,实心球所示原子位于立方体内)类似。每个冰晶胞平均占有
____个水分子, 若冰晶胞的边长为acm,阿伏加德罗常数为NA,冰的密度为d g/cm3,则水的摩尔质量为___________。



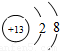
 备战中考寒假系列答案
备战中考寒假系列答案