
��1�������о�֤����ʹ������������ˮ����������������ˮ���л��ﷴӦ��������CHCl3�����ʣ���Щ���ʿ�����DZ�ڵ��°��»����ʡ�Ŀǰ�������з���������ˮ���������������������ʲ���������ˮ���������� ������ţ���
A������ B���������� C������ D����������( Na2FeO4)
��2��������VI����������һ��ˮ�����������Ʊ������У�����������������ʪ�������¹����������������ɷ����ȡ�ʪ�����ڼ�����Һ���ô���������������III���Σ�д���÷������ӷ���ʽ�� ��
��3���ø�����VI��������Ƶĸ�����VI�������һ�����Ϳɳ���أ��������ҺΪKOH��Һ���ŵ�ʱ���ܷ�Ӧ��3Zn+2K2FeO4+8H2O��3Zn(OH)2+2Fe(OH)3+4KOH
��д�����������ĵ缫��Ӧʽ�� ��
���ø�����VI���������Դ����Fe����������Cu��������������KOH��Һ���е�⣬����0.1molK2FeO4��Ӧʱ���ڵ���������H2 L����״������ͬʱ����Fe(OH)3= mol��
���±��г���ij���ŷŵĺ�п��ˮ�еĺ��������һ�����ֵ���й����ݣ�
| ��п��ˮˮ�� | ���������ˮ���һ�����ֵ | |
| Zn2��Ũ��/(mg��L��1) | ��800 | ��3.9 |
| pH | 1��5 | 6��9 |
��������ķ�ˮpH��8����ʱ��ˮ��Zn2����Ũ��Ϊ mg/L�������£�Ksp[Zn(OH)2]��1.2��10-17���� ������ϡ������ϡ������һ�������

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ʼ������Σ������������ε��ǣ� ��
A.NaHSO4 B.Na2SO4 C. Na2SO3 D.Na2S2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������(AlN)��һ���������ǽ������ϡ�ijAlN��Ʒ������Al2O3���ʣ�Ϊ�ⶨAlN�ĺ����������������ʵ�鷽��������֪��AlN+NaOH+H2O��NaAlO2��NH3����
������1��ȡһ��������Ʒ��������װ�òⶨ��Ʒ��AlN�Ĵ���(�г�װ������ȥ)��
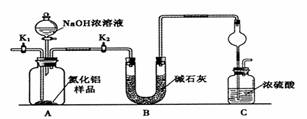
��1����ͼCװ�������θ���ܵ�������______________��
��2���������ʵ�鲽�裺��װ��ʵ��װ�ã����ȼ��װ�������ԣ��ټ���ʵ��ҩƷ����������ʵ������ǹر�K1����K2,��Һ©������������NaOHŨ��Һ�������ٲ������塣��K1��ͨ�뵪��һ��ʱ�䣬�ⶨCװ�÷�Ӧǰ��������仯��ͨ�뵪����Ŀ����______________��
��3������װ�ô���ȱ�ݣ����²ⶨ���ƫ�ߣ�������Ľ����_________��
������2������ͼװ�òⶨm g��Ʒ��A1N�Ĵ���(���ּг�װ������ȥ)��
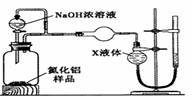
��4��Ϊ�ⶨ������������������װ���е�XҺ�������____________��
a��CCl4 b��H2O c��NH4Cl��Һ d��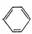
��5��ʵ�����ʱ����ȡ����װ���е�XҺ������ʱӦע���������
�� �� ��
������3�������²���ⶨ��Ʒ��A1N�Ĵ��ȣ�
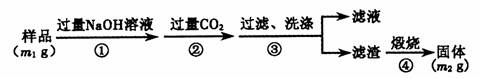
��6����Ʒ��A1N����������Ϊ ���ú�m1 m2�Ĵ���ʽ��ʾ����
��7�����ڲ������δϴ�ӣ��ⶨ�����__________(�ƫ�ߡ�����ƫ�͡���
����Ӱ�족)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
Ǧ���ص������ֱ�ΪPb��PbO2���������ҺΪH2SO4������ʱ�ķ�ӦΪ
Pb��PbO2��2H2SO4��2PbSO4��2H2O�����н�����ȷ����
A��Pb ����������
B����Һ��pH���ϼ�С
C���ŵ�ʱ������Ӧʽ��PbO2 +4H++ SO42-+2e-= PbSO4 +2H2O
D����ҺpH��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
25 ��ʱ,��20 mL 0.1 mol��L-1 NaOH��Һ����μ���0.2 mol��L-1������Һ,������ͼ��ʾ,�й�����Ũ�ȹ�ϵ�ıȽ���,����ȷ����
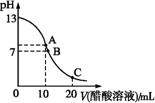 A. ��C��:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
A. ��C��:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.��B��:c(OH-)=c(H+),c(Na+)= c(CH3COO-))
C. ��A��:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D.��C��: c(CH3COO-)+c(CH3COOH)=2c(Na+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NA��ʾ�����ӵ�������ֵ������˵����ȷ����
A��50mL 18.4mol��L-1Ũ����������ͭ�ȷ�Ӧ������SO2������ĿΪ0.46NA
B�����³�ѹ�£�4.6gNO2��N2O4������к���0.3NA��ԭ��
C��1L0.1mol��L-1Na2CO3��Һ�к��е���������Ϊ0.1NA
D����״���£�22.4LCCl4�к���NA������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й��Ȼ�ѧ����ʽ��������ȷ����
A����֪2H2(g)+O2(g) = 2H2O(g) ��H= - 483.6 kJ��mol-1����������ȼ����Ϊ241.8kJ��mol-1
B����֪C��ʯī��s��= C�����ʯ��s�� ��H=+1.9kJ��mol-1������ʯ��ʯī�ȶ�
C����0.5mol NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�26.7kJ�����������ʾ�÷�Ӧ�к��ȵ��Ȼ�ѧ����ʽΪ��OH-��aq�� +H+��aq��= H2O��l�� ��H
+H+��aq��= H2O��l�� ��H =-53.4kJ��mol-1
=-53.4kJ��mol-1
D����֪2H2S��g��+ O2��g��= 2S��g��+2H2O��l�� ��H1 ��
2H2S��g ��+ 3O2��g��=2SO2��g��+2H2O��l����H2����H1>��H2
��+ 3O2��g��=2SO2��g��+2H2O��l����H2����H1>��H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ʱ��Ũ�Ⱥ�����ֱ�Ϊc1��V1��NaOH��Һ��c2��V2��CH3COOH��Һ���ϣ����й��ڸû����Һ������������� (����)
A����pH>7����һ����c1V1��c2V2
B�����κ�����¶���c(Na��)��c(H��)��c(CH3COO��)��c(OH��)
C����pH��7ʱ����V1��V2����һ����c1��c2
D����V1��V2��c1��c2����c(CH3COO��)��c(CH3COOH)��c(Na��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪����ȼ���ȡ�H= -akJ /mol ��д������ȼ���ȵ��Ȼ�ѧ����ʽ______________________________����ȫȼ��һ�����Ķ��飬�ų�������ΪQ����֪Ϊ����ȫ�������ɵ�CO2�����ĵ�4mol/L NaOH��Һ50mL ,��1mol������ȫȼ�շų�������Q���ķ�ΧΪ______________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com