
 ,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究:
,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究: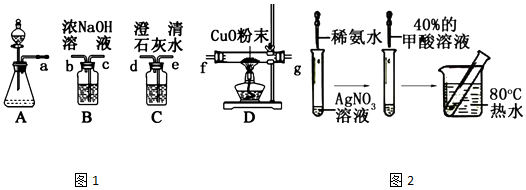
分析 根据实验原理探究HCOOH在浓硫酸作用下分解产生了CO,要检验CO,则通过CuO粉末加热还原,用澄清石灰水检验有二氧化碳产生即可,但防止二氧化碳气体的干扰,所以首先应将生成的气体通入氢氧化钠溶液除去可能含有的二氧化碳酸性气体,再通入CuO粉末加热还原,最后将生成的气体通入澄清石灰水检验,据此分析;
(1)甲酸在浓硫酸作用下易分解产生CO和水;
(2)根据实验原理探究HCOOH在浓硫酸作用下分解产生了CO,即将生成的气体首先通入氢氧化钠溶液除去可能含有的二氧化碳酸性气体,再通入CuO粉末加热还原,最后将生成的气体通入澄清石灰水检验;
(3)根据CO还原氧化铜生成红色的铜和二氧化碳判断;
(4)CO有毒,无尾气处理装置;
(5)根据甲酸的醛基在碱性条件下被银氨溶液氧化,产生光亮的银镜分析;
(6)根据甲酸的醛基在碱性条件下被银氨溶液氧化,可以先将溶液调成碱性再做银镜反应观察现象即可判断.
解答 解:(1)甲酸在浓硫酸作用下易分解产生CO和水,方程式为:HCOOH$\stackrel{H_{2}SO_{4}}{→}$CO↑+H2O,故答案为:HCOOH$\stackrel{H_{2}SO_{4}}{→}$CO↑+H2O;
(2)根据实验原理探究HCOOH在浓硫酸作用下分解产生了CO,即将生成的气体首先通入氢氧化钠溶液除去可能含有的二氧化碳酸性气体,再通入CuO粉末加热还原,最后将生成的气体通入澄清石灰水来检验是否有二氧化碳生成,所以装置的连接顺序为acbfged,故答案为:cbfged;
(3)根据(2)的装置连接,CO还原氧化铜生成红色的铜和二氧化碳,所以HCOOH的分解产物中有CO的现象是D中黑色粉末变成红色,C中澄清石灰水变浑浊,故答案为:D中黑色粉末变成红色,C中澄清石灰水变浑浊;
(4)因为CO有毒,所以多余的CO要处理,则该实验设计有一处明显的缺陷是无尾气处理装置,故答案为:无尾气处理装置;
(5)甲酸的结构为 ,分子中含有醛基、羧基,应具有还原性和酸性等性质,理论上甲酸的醛基在碱性条件下被氧化银氨溶液氧化,产生光亮的银镜,而实验中没有出现预期的现象的可能原因是由于HCOOH的酸性较强,破坏了发生银镜反应的碱性条件,
,分子中含有醛基、羧基,应具有还原性和酸性等性质,理论上甲酸的醛基在碱性条件下被氧化银氨溶液氧化,产生光亮的银镜,而实验中没有出现预期的现象的可能原因是由于HCOOH的酸性较强,破坏了发生银镜反应的碱性条件,
故答案为:由于HCOOH的酸性较强,破坏了发生银镜反应的碱性条件;
(6)根据甲酸的醛基在碱性条件下被银氨溶液氧化,所以可以先将溶液调成碱性再做银镜反应观察,则实验设计为:先将HCOOH用NaOH溶液中和至弱碱性,再加入到银氨溶液中进行银镜反应,若产生光亮的银镜,说明HCOOH发生银镜反应需在碱性环境下进行,故答案为:先将HCOOH用NaOH溶液中和至弱碱性,再加入到银氨溶液中进行银镜反应,若产生光亮的银镜,说明HCOOH发生银镜反应需在碱性环境下进行.
点评 本题主要考查了甲酸分解产物的检验及其甲酸本身的性质,解答时抓住实验设计原理和官能团性质是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中红棕色气体慢慢变浅 | ②反应的化学方程式 8NH3+6NO2 $\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
| 打开K2 | ③Z中NaOH溶液产生倒吸现象 | ④反应后气体分子数减少,Y管中压强小于外压 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.1 mol/L AlCl3溶液 | B. | 20 mL 0.1 mol/L CaCl2溶液 | ||
| C. | 30 mL 0.2 mol/L KCl溶液 | D. | 200 mL 2 mol•L-1KClO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A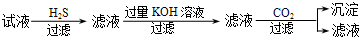 | |
| B. | B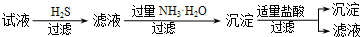 | |
| C. | C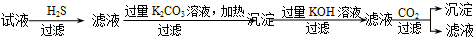 | |
| D. | D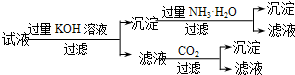 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
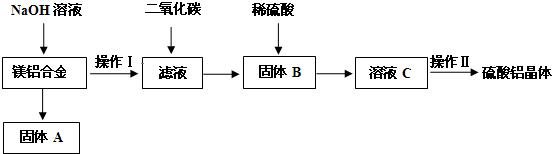
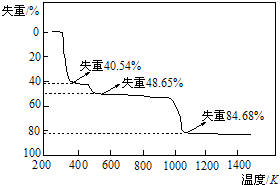
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com