
【题目】2019年10月22日,位于资阳市境内的“安岳气田”天然气产量达到10.33亿立方米,历史性突破10亿立方米大关。“安岳气田”的开发,将惠及川渝地区天然气供给,促进地方经济社会的发展。对天然气的高效利用不仅能缓解大气变暖,而且对日益枯竭的石油资源也有一定的补充作用。
(1)已知甲烷临氧耦合CO2重整反应有:
反应I:2CH4(g)+O2(g)![]() 2CO(g)+4H2(g) △H=-71.4 kJ·mol-1
2CO(g)+4H2(g) △H=-71.4 kJ·mol-1
反应II:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+247.0 kJ·mol-1
2CO(g)+2H2(g) △H=+247.0 kJ·mol-1
已知断裂1 mol化学键所需的能量:
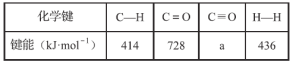
①a=_________。
②写出表示CO燃烧热的热化学方程式:____________________________________。
(2)在两个体积均为2L的恒容密闭容器中,起始时按表中相应的量加入物质,在温度为753K下进行(1)中反应II(不发生其它反应),CO2的平衡转化率如下表所示:
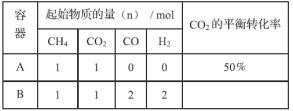
①若容器A中反应从开始到平衡所用的时间为t min,则t min内该反应的平均反应速率为:v(CO2)=_________(用含t的表达式表示)。
②温度为753K时该反应的平衡常数K=_________;容器B中的反应起始时将_________移动(填“正向”、“逆向”或“不”)。
③该反应达到平衡时,其他条件不变,若升高温度,此时v正_________ v逆(填“>”、“=”或“<”)。
④当容器A、B中的反应均达到平衡时,容器中n(CO)满足的关系:2n(CO)A______n(CO)B(填“>”、“=”或“<”)。
(3)将CH4(g)和O2(g)以物质的量比为4:3充入盛有催化剂的恒容密闭容器内,发生(1)中反应I,相同时间段内测得CO的体积分数[φ(CO)]与温度(T)的关系如图如示。
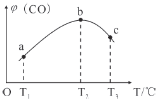
bc段CO的体积分数[φ(CO)]降低的主要原因是____________________________________。
【答案】996.5 CO(g)+1/2O2(g)= CO2(g) △H= -282.7 kJ·mol-1 0.25/t(mol·L-1·min-1) 1 逆向 > > b点反应达到平衡后,因为正反应为放热反应,升高温度,平衡逆向移动,故温度越高,CO的体积分数就越小
【解析】
(1)①反应II的△H=E(反应物的总键能)-E(生成物的总键能);
②(反应I)×(1/2)-( 反应II)得:CO(g)+1/2O2(g)= CO2(g);
(2)①容器A中反应从开始到平衡所用的时间为t min,CO2的平衡转化率为50%,可以计算出反应中消耗CO2的物质的量,然后计算出反应速率;
②结合图中CO2的平衡转化率为50%,计算出平衡时c(CH4)、c(CO2)、c(CO)、c(H2),求出K;利用Qc与K的大小关系判断v正、v逆大小;
③因为该反应正反应为吸热反应,该反应达到平衡时,其他条件不变,若升高温度,平衡向正向移动;
④由②可知当容器A、B中的反应均达到平衡时,容器中n(CO)满足的关系;
(3)结合图像和题中信息判断。
(1)①反应II的△H=E(反应物的总键能)-E(生成物的总键能)=(4×414+2×728)-(2a+2×436)= +247.0,a=996.5;
②(反应I)×![]() )-( 反应II)得:CO(g)+1/2O2(g)= CO2(g) △H=(1/2) ×(-71.4 kJ·mol-1) -( +247.0 kJ·mol-1)= -282.7 kJ·mol-1;
)-( 反应II)得:CO(g)+1/2O2(g)= CO2(g) △H=(1/2) ×(-71.4 kJ·mol-1) -( +247.0 kJ·mol-1)= -282.7 kJ·mol-1;
(2)①容器A中反应从开始到平衡所用的时间为t min,CO2的平衡转化率为50%,反应中消耗CO2的物质的量为0.5mol,v(CO2)=(0.5mol)/[( 2L) ×(t min)]=0.25/t(mol·L-1·min-1);
②CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),CO2的平衡转化率为50%,故平衡时n(CH4)=n(CO2)= 0.5mol,n(CO)=n(H2)=1mol,c(CH4)=c(CO2)=
2CO(g)+2H2(g),CO2的平衡转化率为50%,故平衡时n(CH4)=n(CO2)= 0.5mol,n(CO)=n(H2)=1mol,c(CH4)=c(CO2)=![]() =0.25mol/L,c(CO)=c(H2)=
=0.25mol/L,c(CO)=c(H2)=![]() =0.5mol/L,该反应的平衡常数K=(0.52×0.52)/(0.25×0.25)=1;容器B中的c(CH4)=c(CO2)=
=0.5mol/L,该反应的平衡常数K=(0.52×0.52)/(0.25×0.25)=1;容器B中的c(CH4)=c(CO2)= ![]() =0.5mol/L,c(CO)=c(H2)=
=0.5mol/L,c(CO)=c(H2)=![]() =1mol/L,Qc=(12×12)/(0.5×0.5)=4>K,故容器B中的反应起始时将逆向移动;
=1mol/L,Qc=(12×12)/(0.5×0.5)=4>K,故容器B中的反应起始时将逆向移动;
③因为该反应正反应为吸热反应,该反应达到平衡时,其他条件不变,若升高温度,平衡向正向移动,v正> v逆;
④由②可知当容器A、B中的反应均达到平衡时,容器中n(CO)满足的关系:2n(CO)A>n(CO)B;
(3)T2之前,反应没有达到平衡,温度越高,反应速率越快,相同时间内生成的CO越多,b点反应达到平衡后,因为正反应为放热反应,升高温度,平衡逆向移动,故温度越高,CO的体积分数就越小。


科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙二醇滴眼液的商品标签部分信息如图所示(乙二醇的结构简式为HOCH2CH2OH),结合所学知识分析,下列观点不正确的是

A. 乙二醇与丙二醇互为同系物
B. 聚乙二醇和丙二醇均为无毒易溶于水的有机物
C. 乙烯、乙二醇均能使酸性高锰酸钾溶液褪色,且原理相同
D. 一定条件下,乙二醇与足量乙酸充分酯化所得产物的分子式为C6H12O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2NO(g)+O2(g)![]() 2NO2(g) △H1 K1
2NO2(g) △H1 K1
2NO2(g)![]() N2O4(g) △H2 K2
N2O4(g) △H2 K2
2NO(g)+O2(g)![]() N2O4(g) △H3 K3
N2O4(g) △H3 K3
则下列关系式正确的是
A.K1×K2=K3 △H1×△H2=△H3
B.K1×K2=K3 △H1+△H2=△H3
C.K1+K2=K3 △H1×△H2=△H3
D.K1+K2=K3 △H1+△H2=△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下列要求作答。
(1)第二周期中,第一电离能介于B和N之间的元素共有_________种。
(2)第四周期中,原子核外电子排布有两个未成对电子的元素有_________种。
(3)硅烷(Si,H2H2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是___________________________。
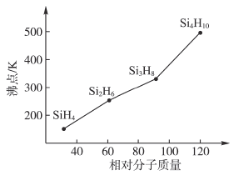
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期元素,它们在周期表中的位置如图所示,下列说法正确的是( )
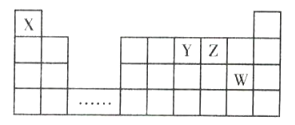
A.四种元素的原子半径由小到大的顺序为r(X)<r(Z)<r(W)<r(Y)
B.X、Y、Z既能形成离子化合物,又能形成共价化合物
C.X与其余三种元素之间形成的核外电子总数为10的微粒只有2种
D.H2Z与HW所含的化学键类型不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是(已知质子交换膜只允许H+通过)( )

A.该制氢工艺中光能最终转化为化学能
B.该装置工作时,H+由b极区流向a极区
C.a极上发生的电极反应为Fe3++e-=Fe2+
D.a极区需不断补充含Fe3+和Fe2+的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废液经测定得知主要含有乙醇,其中还含有丙酮、乙酸和乙酯乙酯。根据下表中各物质的性质,按下列步骤回收乙醇和乙酸。
已知:乙酸乙酯在碱性条件下水解生成乙酸钠和乙醇。
物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
沸点/℃ | 56.2 | 77.06 | 78.5 | 117.9 |
①向废液中加入烧碱溶液,调整溶液的pH=10;②将混合液放入蒸馏器中缓缓加热;③收集温度在70~85℃时的馏出物;④排出蒸馏器中的残液,冷却后向其中加浓硫酸(过量),然后再放入耐蒸馏器中进行蒸馏,回收馏出物。请回答下列问题:
(1)加入烧碱使溶液的pH=10的目的是_______________________。
(2)在70~85℃时馏出物的主要成分是________。
(3)在步骤④中加入过量浓硫酸的目的是(用化学方程式表示)_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.溴化亚铁溶液中通少量的氯气:2Br-+ Cl2=== 2Cl-+ Br2
B.氢氧化铁悬浊液溶于氢碘酸溶液中:2Fe(OH)3+6H++2I- = 2Fe2++I2+6H2O
C.碳酸氢钙与少量的NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
D.稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com