
| A、铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | ||
B、氢氧化钡溶液跟稀硫酸反应:Ba 2++OH-+H++S
| ||
| C、钠和水的反应:Na+H2O═2OH-+H2↑ | ||
D、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O═Al(OH)2↓+3NH
|


科目:高中化学 来源: 题型:
| 实验要求 | 选项的标号 | 供选择的化学试剂(或操作) |
| (1)证明马铃薯中含淀粉 | A.品红试液 B.溴的四氯化碳溶液 C.溶解、过滤,蒸发 D.碘水 | |
| (2)检验SO2具有漂白性 | ||
| (3)除去甲烷中的乙烯 | ||
| (4)除去粗盐中少量的泥沙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠着火时用泡沫灭火器扑灭 |
| B、硅酸钠溶液与盐酸反应可制得硅酸 |
| C、浓硫酸溅到皮肤上,立即用氢氧化钠溶液清洗 |
| D、欲配置500mL 1mol/LNaOH溶液,应将20gNaOH固体溶于500mL水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使用催化剂一定能加快反应速率 |
| B、用粉末状锌代替块状锌与稀硫酸反应一定会加快反应速率 |
| C、当反应物与生成物浓度相等时,可逆反应一定已达到化学平衡状态 |
| D、在合成氨反应中,增大N2浓度一定可以使H2的转化率达到100% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在硫酸铜溶液中加入过量的氢氧化钡溶液:Ba2++SO42-═BaSO4↓ |
| B、二氧化碳通入碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- |
| C、金属钠投入水中:Na+2H2O═Na++2OH-+H2↑ |
| D、氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-═3Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 试管 | 盐酸浓度 | 温度 | 锌的状态 |
| A | 0.5mol?L-1 | 20℃ | 块 状 |
| B | 0.5mol?L-1 | 20℃ | 粉末状 |
| C | 2mol?L-1 | 35℃ | 粉末状 |
| D | 1.8mol?L-1 | 35℃ | 粉末状 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
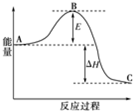 合成氨反应N2(g)+3H2(g)=2NH3(g),反应过程的能量变化如图所示.已知N2(g)与H2(g)反应生成17g NH3(g),放出46.1kJ的热量.
合成氨反应N2(g)+3H2(g)=2NH3(g),反应过程的能量变化如图所示.已知N2(g)与H2(g)反应生成17g NH3(g),放出46.1kJ的热量.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com