
【题目】A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如下图所示.A元素的某种同位素原子没有中子,D元素的原子序数是C的2倍,E是短周期主族元素中半径最大的元素.下列说法不正确的是( )
A.简单离子的半径大小关系:B>C>E
B.D,E两种元素形成的化合物,可能含有离子键和共价键
C.A,B,C三种元素形成的化合物,晶体类型一定相同
D.B,D分别和C形成的化合物,都有可能使溴水或品红溶液褪色
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,含有杂质SiO2、Fe2O3、MgO。工业上从铝土矿中提取Al可采用如图所示工艺流程:
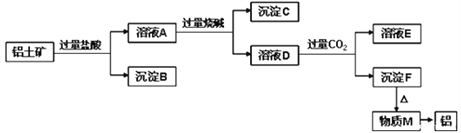
请回答下列问题:
(1)铝土矿加入盐酸后生成Al3+的离子方程式为_____________________________。
(2)沉淀B与烧碱反应的离子方程式为______________________________________。
(3)溶液D中通入过量CO2的离子方程式为_____________________________。
(4)“通入过量CO2”能否改用过量盐酸________(填“能或否”),原因是_____________。
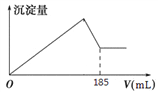
(5)向共含有0.05mol Al3+、Fe3+的溶液中滴入1mol/L NaOH 溶液,生成沉淀的量与加入NaOH 溶液的体积关系如图所示。 则溶液中Al3+的物质的量为_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
探究一:
(1)将已去除表面氧化物的铁钉(碳素钢-含杂质碳)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____________________________________________________。
(2)称取碳素钢6.0g放入15.0ml浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用____________(选填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN溶液 C.浓氨水 D.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,发生SO2+Br2+2H2O=2HBr+H2SO4反应,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g。由此推知气体Y中SO2的体积分数的方法为_________________________________。
探究二:根据上述实验中SO2体积分数(80%)的分析,丙同学认为气体Y中还可能含有氢气和二氧化碳两种气体,为此设计了下列探究实验装置(假设有关气体完全反应)
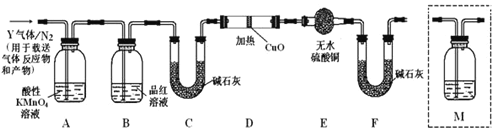
(3)装置B中试剂的作用是_______________________________________;
(4)分析Y气体中的CO2气体是如何生成的______(用化学方程式表示)。
(5)已知洗气瓶M中盛装澄清石灰水,为确认CO2的存在,需在装置中添加洗气瓶M于____________(填序号)。
A.A之前 B.A-B间 C.B-C间 D.C-D间
(6)如果气体Y中含有H2,预计实验现象应是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,一种气态烷烃和一种气态烯烃的混合物9克,其密度是相同条件下H2密度的11.25倍.当混合物通过足量的溴水时,溴水增重4.2克,则这两种气态烃是( )
A.C2H6和C2H4
B.CH4和C3H6
C.CH4和C2H4
D.CH4和C4H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中因发生氧化还原反应而不能大量共存的是
A. H+、NO3—、Fe2+、Na+ B. Ag+、NO3—、Cl—、K+
C. K+、Ba2+、OH—、SO42— D. Cu2+、NH4+、Br—、OH—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸:H2C2O4 ![]() HC2O4-+ H+ Ka 1 ; HC2O4-
HC2O4-+ H+ Ka 1 ; HC2O4- ![]() C2O42-+ H + Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )
C2O42-+ H + Ka 2常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中 H2C2O4、HC2O4-、C2O42- 三种微粒的物质的量分数(δ)与溶液 pH 的关系如图所示,则下列说法中不正确的是( )
A.常温下,Ka1 :Ka2 =1000
B.将相同物质的量KHC2O4和K2C2O4固体完全溶于水可配得 pH为4.2的混合液
C.pH=1.2 溶液中:c(K + ) + c(H + ) = c(OH-) + c(H2C2O4)
D.向 pH=1.2 的溶液中加 KOH 溶液将pH增大至4.2的过程中水的电离度一直增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.把5.1 g镁铝合金的粉末放入过量的盐酸中,得到5.6 L H2(标准状况下)。
(1)合金中镁的物质的量为_______。
(2)写出该合金溶于足量NaOH溶液的化学方程式:_______。
Ⅱ.在一定质量的AlCl3和MgCl2混合溶液中逐渐滴入一定溶质质量分数的NaOH溶液,生成沉淀的物质的量与加入NaOH的物质的量的关系如图所示。
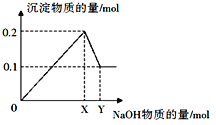
(1)生成Mg(OH)2的质量为__________。
(2)X=_______;Y=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究新制饱和氯水的成分,进行如下实验,下列实验现象及结论不合理的是:
A. 呈现浅黄绿色,说明氯水含有Cl2
B. 向饱和氯水中加入稀硝酸酸化后的AgNO3溶液,产生白色沉淀,说明含有Cl—
C. 向饱和氯水中加入NaHCO3粉末,有气泡产生,说明含有H+
D. 向饱和氯水中加入品红溶液褪色,说明含有Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作不能达到目的是( )
选项 | 目的 | 操作 |
A | 配制100mL1.0molL﹣1CuSO4 | 将25.0gCuSO45H2O溶于蒸馏水配成100mL溶液 |
B | 除去KNO3固体中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
C | 检验溶液是否含有SO | 取少量待测液于试管中,加入硝酸酸化的Ba(NO3)2溶液 |
D | 检验溶液中是否含有NH | 取少量溶液于试管中,加入NaOH后,加热,在试管口放置一片湿润的红色石蕊试纸 |
A.A
B.B
C.C
D.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com