

分析 (1)负极发生反应,甲醇在负极失去电子,酸性条件下生成二氧化碳,根据电荷守恒有氢离子生成;
(2)已知:①CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1=-35.4kJ•mol-1,
②CO(g)+2H2(g)?CH3OH (g)△H2=-90.1kJ•mol-1,
③2CH4(g)+O2(g)?2CH3OH(g)△H3,
盖斯定律,可知①×2+②×2=③,故反应热也进行相应计算,方程式相加时总平衡常数等于分方程的平衡常数之积;
(3)①由图可知,压强一定时,温度越高,CH3OH的物质的量越小,说明升高温度平衡向逆反应方向移动;
②正反应为气体体积减小的反应,温度一定时,增大压强,平衡向正反应方向移动,甲醇的物质的量增大;
③M点甲醇物质的量为0.25mol,计算平衡时各组分物质的量浓度,代入平衡常数表达式K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$计算;
(4)甲醇与醇ROH在浓硫酸及加热条件下制备汽油抗爆震剂 MTBE,MTBE的分子式为C5H12O,醇ROH为丁醇,MTBE核磁共振氢谱有2个吸收峰,则醇ROH有2种H原子,醇ROH结构简式为(CH3)3COH.
解答 解:(1)负极发生反应,甲醇在负极失去电子,酸性条件下生成二氧化碳,根据电荷守恒有氢离子生成,负极电极反应式为:CH3OH+H2O-6e-=CO2+6H+,
故答案为:CH3OH+H2O-6e-=CO2+6H+;
(2)已知:①CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1=-35.4kJ•mol-1,
②CO(g)+2H2(g)?CH3OH (g)△H2=-90.1kJ•mol-1,
③2CH4(g)+O2(g)?2CH3OH(g)△H3,
盖斯定律,可知①×2+②×2=③,故△H3=2△H1+2△H2=2×(-35.4kJ•mol-1-90.1kJ•mol-1)=-251kJ•mol-1,则总方程的平衡常数等于分方程的平衡常数之积,则平衡常数K3=K12•K22,
故答案为:-251;K12•K22;
(3)①由图可知,压强一定时,温度越高,CH3OH的物质的量越小,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,故答案为:放热;
②正反应为气体体积减小的反应,温度一定时,增大压强,平衡向正反应方向移动,甲醇的物质的量增大,故压强P1>P2,故答案为:>;
③M点甲醇物质的量为0.25mol,则:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
开始(mol):1 2.75 0 0
转化(mol):0.25 0.75 0.25 0.25
平衡(mol):0.75 2 0.25 0.25
容器体积为10L,则平衡时CO2、H2、CH3OH、H2O(g)浓度分别为0.075mol/L、0.2mol/L、0.025mol、L、0.025mol/L,故K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$=$\frac{0.025×0.025}{0.075×0.{2}^{3}}$=1.04,故答案为:1.04;
(4)甲醇与醇ROH在浓硫酸及加热条件下制备汽油抗爆震剂 MTBE,MTBE的分子式为C5H12O,醇ROH为丁醇,MTBE核磁共振氢谱有2个吸收峰,则醇ROH有2种H原子,醇ROH结构简式为(CH3)3COH.
①ROH的名称为:2-甲基-2-丙醇,故答案为:2-甲基-2-丙醇;
②制备MTBE的化学方程式:CH3OH+(CH3)3COH$→_{△}^{浓硫酸}$CH3OC(CH3)3+H2O,故答案为:CH3OH+(CH3)3COH$→_{△}^{浓硫酸}$CH3OC(CH3)3+H2O.
点评 本题属于拼合型题目,涉及原电池、反应热计算、化学平衡常数、化学平衡影响因素、有机物推断等,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
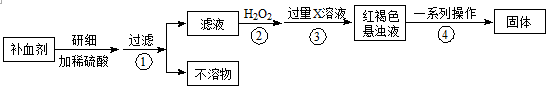
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
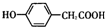 ;写出A与NaHCO3溶液反应的化学方程式
;写出A与NaHCO3溶液反应的化学方程式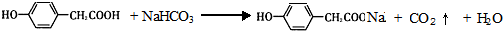 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 $→_{FeCl_{3}}^{Cl_{2}}$分离得A$→_{过氧化苯甲酰}^{NBS}$
$→_{FeCl_{3}}^{Cl_{2}}$分离得A$→_{过氧化苯甲酰}^{NBS}$ $\stackrel{NaCN}{→}$B$→_{50%NaOH}^{CH_{3}CHClCH_{3}}$
$\stackrel{NaCN}{→}$B$→_{50%NaOH}^{CH_{3}CHClCH_{3}}$ $→_{②SOCl_{2}}^{①H+}$C
$→_{②SOCl_{2}}^{①H+}$C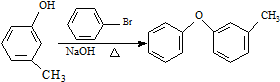 $→_{Co(OAc)_{2}}^{O_{2}}$
$→_{Co(OAc)_{2}}^{O_{2}}$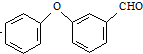 $→_{H+}^{NaCN}$D
$→_{H+}^{NaCN}$D +HCl
+HCl 中的官能团有醚键和醛基(填名称).
中的官能团有醚键和醛基(填名称).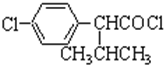 ;合成3中的有机反应类型为取代反应.
;合成3中的有机反应类型为取代反应. .
. )合成一种抗早产药的重要中间体.根据已有知识并结合相关信息,写出以CH3Br和
)合成一种抗早产药的重要中间体.根据已有知识并结合相关信息,写出以CH3Br和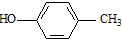 为有机原料(无机试剂和反应条件任选)合成E的路线流程图.合成路线流程图示例如下:CH2═CH2$→_{催化剂}^{O_{2}}$CH3CHO$→_{催化剂}^{O_{2}}$CH3COOH.
为有机原料(无机试剂和反应条件任选)合成E的路线流程图.合成路线流程图示例如下:CH2═CH2$→_{催化剂}^{O_{2}}$CH3CHO$→_{催化剂}^{O_{2}}$CH3COOH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500 mL lmol/L Fe2(SO4)3溶液和250 mL 3 mol/L的Na2S04溶液所含硫酸根离子的浓度相等 | |
| B. | 若R的含氧酸的酸性大于Q的含氧酸的酸性,则非金属性R大于Q | |
| C. | 1.2 g NaHS04晶体中阳离子和阴离子的总数为O.03NA | |
| D. | 含NA个Na+的Na2O溶解于1 L水中,Na+的物质的量浓度为1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
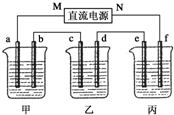 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.
5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com