
2008年北京奥运会所用火炬燃料为丙烷(C3H8),悉尼奥运会所用火炬燃料为65%丁烷(C4H10)和35%丙烷(C3H8),已知常温下1mol丙烷燃烧放出2220kJ热量,1mol正丁烷燃烧放出2878kJ热量,1mol异丁烷燃烧放出2869.6kJ热量.试回答下列问题:
(1)表示正丁烷燃烧的热化学反应方程式 ;
(2)下列有关说法正确的是 ;
A.奥运火炬燃烧时的能量转化主要是由化学能转变为热能
B.相同条件下,正丁烷的热值比丙烷大
C.正丁烷比异丁烷不稳定
D.异丁烷分子中的碳氢键比正丁烷的多
(3)已知1mol H2燃烧生成液态水放出热量是285.8kJ,现有5mol 氢气和丙烷的混合气体,完全燃烧时放热3847kJ,则氢气和丙烷的体积比为 .
| 热化学方程式;化学能与热能的相互转化;有关混合物反应的计算. | |
| 专题: | 化学反应中的能量变化. |
| 分析: | (1)依据热化学方程式的书写方法,标注物质聚集状态和对应焓变写出; (2)A、燃料燃烧放热,化学能转化为热能; B、依据热值含义分析计算比较;1千克(每立方米)某种固体(气体)燃料完全燃烧放出的热量称为该燃料的热值; C、依据燃烧热化学方程式的焓变分析,能量越高越不稳定; D、异丁烷分子中的碳氢键和正丁烷的相同; (3)依据常温下1mol丙烷燃烧放出2220kJ热量,1mol H2燃烧生成液态水放出热量是285.8kJ,结合题干条件分析计算. |
| 解答: | 解:(1)1mol正丁烷燃烧放出2878kJ热量,常温下反应生成的水为液体,依据热化学方程式书写方法写出热化学方程式:C4H10(正丁烷,g)+13/2O2(g)→4CO2(g)+5H2O(l)△H=﹣2878 kJ•mol﹣1, 故答案为:C4H10(正丁烷,g)+13/2O2(g)→4CO2(g)+5H2O(l)△H=﹣2878 kJ•mol﹣1; (2)A、燃料燃烧放热,化学能转化为热能,故A正确; B、依据热值含义分析计算比较;1千克(每立方米)某种固体(气体)燃料完全燃烧放出的热量称为该燃料的热值;正丁烷热值=49.6,丙烷热值= C、依据燃烧热化学方程式的焓变分析,1mol正丁烷燃烧放热小于异丁烷燃烧放热,说明异丁烷能量高于正丁烷,能量越高越不稳定;正丁烷比异丁烷不稳定,故C正确; D、异丁烷分子中的碳氢键和正丁烷的相同,故D错误; 故答案为:AC; (3)1mol丙烷燃烧放出2220kJ热量,1mol H2燃烧生成液态水放出热量是285.8kJ,设5mol 氢气和丙烷的混合气体中丙烷物质的量为x,氢气为5﹣x, 2220x+(5﹣x)285.8=3847 x=1.25mol,氢气物质的量3.75mol,氢气和丙烷的体积比等于氢气和丙烷的物质的量之比=3.75:1.25=3:1, 故答案为:3:1. |
| 点评: | 本题考查了热化学方程式书写方法,物质能量比较方法,热化学方程式的计算应用,题目难度中等. |


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
下列事实不能用平衡移动原理解释的是()
A. 工业合成氨时使用催化剂
B. 配制FeCl3溶液时加入少量的盐酸
C. 在NaOH溶液中由水电离出的c(H+)<1×10﹣7 mol/L
D. AgCl在水中的溶解度大于在饱和NaCl溶液中的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)===CO2(g) ΔH1
C(s)+ O2(g)===CO(g) ΔH2
O2(g)===CO(g) ΔH2
②S(s)+O2(g)===SO2(g) ΔH3
S(g)+O2(g)===SO2(g) ΔH4
③H2(g)+ O2(g)===H2O(l) ΔH5
O2(g)===H2O(l) ΔH5
2H2(g)+O2(g)===2H2O(l) ΔH6
④CaCO3(s)===CaO(s)+CO2(g) ΔH7
CaO(s)+H2O(l)===Ca(OH)2(s) ΔH8
A.① B.④
C.②③④ D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度时,将1mol A和2mol B放入容积为5L的某密闭容器中发生如下反应:A(s)+2B(g)⇌C(g)+2D(g),经5min后,测得容器内B物质的浓度减少了0.2mol•L﹣1.下列叙述不正确的是( )
|
| A. | 在5min内该反应用C的浓度变化表示的反应速率为0.02mol•L﹣1•min﹣1 |
|
| B. | 在5min时,容器内D的浓度为0.2mol•L﹣1 |
|
| C. | 该反应随着反应的进行,容器内压强逐渐增大 |
|
| D. | 5min时容器内气体总的物质的量为3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:①101kPa时,C(s)+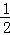 O2(g)=CO(g);△H1=﹣110.5kJ/mol②稀溶液中,H+(aq)+OH﹣(aq)=H2O(1);△H2=﹣57.3kJ/mol,下列结论正确的是( )
O2(g)=CO(g);△H1=﹣110.5kJ/mol②稀溶液中,H+(aq)+OH﹣(aq)=H2O(1);△H2=﹣57.3kJ/mol,下列结论正确的是( )
|
| A. | 若碳的燃烧热用△H3来表示,则△H3<△H1 |
|
| B. | 若碳的燃烧热用△H3来表示,则△H3>△H1 |
|
| C. | 稀硫酸与稀NaOH溶液反应的中和热△H=﹣57.3kJ/mol |
|
| D. | 浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 |
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省西安市高一上学期期末考试化学试卷(解析版) 题型:填空题
(9分)已知某待测液由Ag+、Mg2+、K+、Ba2+、NH4+ 、NO3-中的若干种离子组成,进行如下实验:第一步:加入过量的稀盐酸,有白色沉淀生成。
第二步:过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
第三步:再过滤,取少量滤液,滴入NaOH溶液至溶液呈碱性,在此过程中溶液无明显现象,加热该溶液,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:
(1)分别写出第二步和第三步中所涉及的反应的离子方程式:
第二步: 第三步: ;
(2)待测液中一定含有 、NO3-离子,一定不含有 离子,还有一种离子不能确定其是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象及结论,不要求写实验操作过程) , 。
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省西安市高一上学期期末考试化学试卷(解析版) 题型:选择题
已知5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O,下列说法不正确的是
A.KClO3是氧化剂
B.被氧化与被还原的氯元素的质量比为5:1
C.H2SO4既不是氧化剂又不是还原剂
D.1mol KClO3参加反应时有10mol电子转移
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省西安市高一上学期期末考试化学试卷(解析版) 题型:选择题
在下列状态下,能导电的电解质是
A.氨水 B.液态氯化氢 C.二氧化碳气体 D.熔融氯化钠
查看答案和解析>>
科目:高中化学 来源:2014-2015宁夏银川市高一下学期3月月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下22.4 L氢气和氧气的混合气体所含分子总数为NA
B.1 mol Na2O2固体中含离子总数为4NA
C.5.6g Fe和足量的盐酸反应时,失去的电子数为0.3NA
D.0.5mol/L的MgCl2溶液中,含有Cl- 个数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com