
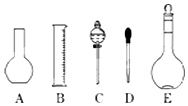
 实验室需要0.1mol/L NaOH溶液500mL.根据这种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液500mL.根据这种溶液的配制情况回答下列问题:分析 (1)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀等,据此选择需要仪器;依据仪器C形状说出其名称;依据配制溶液体积选择合适规格容量瓶;
(2)容量瓶为配制一定物质的浓度、一定体积的溶液专用仪器,不能用于溶解固体、稀释浓溶液,不能用来做反应容器,不能用来长期存储液体;
(3)依据m=CVM计算需要溶质的质量,依据定容的正确操作解答;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀等,用到的仪器:托盘天平、药匙、烧杯、量筒、玻璃棒、500mL容量瓶、胶头滴管,所以用不到的仪器:平地烧瓶、分液漏斗;依据C形状可知C为分液漏斗;需要0.1mol/L NaOH溶液500mL,应选择500mL容量瓶;
故答案为:AC;分液漏斗;500;
(2)容量瓶为配制一定物质的浓度、一定体积的溶液专用仪器,不能用于溶解固体、稀释浓溶液,不能用来做反应容器,不能用来长期存储液体,可以量取特定体积的溶液;
故选:AD;
(3)需要0.1mol/L NaOH溶液500mL,应称取氢氧化钠质量m=0.1mol/L×0.5L×40g/mol=2.0g;
定容时,继续加水至液面接近容量瓶刻度线1-2cm处时,改用胶头滴管加蒸馏水至溶液的凹液面最低点刚好与刻度线相切;
故答案为;2.0;1-2cm;胶头滴管;
(4)在配制NaOH溶液实验中,其他操作均正确.若定容时仰视刻度线,导致溶液体积偏大,则所配制溶液浓度小于0.1mol/L;若NaOH溶液未冷却即转移至容量瓶定容,冷却后,溶液体积偏小,则所配制溶液浓度大于0.1mol/L;
故答案为:小于;大于.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意容量瓶规格选择及使用注意事项,题目难度不大.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减小 | |
| B. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$不变 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 醋酸的电离常数K随醋酸浓度减小而减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制一定物质的量浓度的溶液实验中,定容时,俯视观察刻度线,会引起配制溶液的浓度偏高 | |
| B. | 分液漏斗中上层和下层液体均可以从下口流出 | |
| C. | 冷凝管使用时冷水既可以从上口进也可以从下口进 | |
| D. | 不能用丁达尔效应鉴别Fe(OH)3胶体和CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,18g H2O 中含有的原子总数无法计算 | |
| B. | 在标准状况时,20mL NH3 与60mL O2所含的分子个数比为1:3 | |
| C. | 将80g NaOH 溶于1L水中,所得溶液中NaOH 的物质的量浓度为2 mol•L-1 | |
| D. | 1L 0.25mol/L H2SO4 溶液中含有6.02×1023个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na | B. | FeCl3溶液 | C. | KMnO4酸性溶液 | D. | 溴水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCOOH+H2O?HCOO-+H3O+ | B. | CO32-+H2O?HCO3-+OH- | ||
| C. | CO2+H2O?HCO3-+H+ | D. | HS-?S2-+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com