
【题目】实验室制取氯气的装置如图:
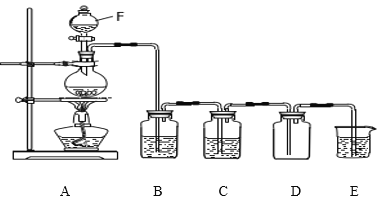
(1)仪器F的名称是_____________;按图组装好装置后首先要进行的操作是:_________________。
(2)写出E中发生反应的离子方程式:_____________________________________________________。
(3)实验室也可以用浓盐酸与高锰酸钾反应来制取少量的氯气,反应的化学方程式为:2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O,则该反应的氧化产物是_____________________。
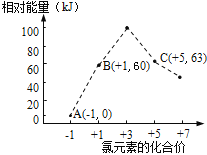
(4)氯元素能形成多种离子。在水溶液中1 mol Cl-、1 molClOx-(x=1,2,3,4)能量的相对大小如图所示,试判断B→A+C反应是___________反应(填“吸热”或“放热”);若有1.5molB发生反应,转移电子的物质的量为___________mol。
【答案】分液漏斗 检查装置气密性 Cl2 + 2OH— = Cl— + ClO— + H2O Cl2 放热 2
【解析】
(1)-(3)制备气体时,安装好装置后,需要检查装置的气密性;实验室用二氧化锰与浓盐酸加热制备氯气中混有氯化氢和水蒸气,可以用饱和食盐水和浓硫酸进行除杂和干燥;氯气有毒,尾气需要碱液吸收处理;也可以用高锰酸钾溶液与浓盐酸反应,高锰酸钾做氧化剂,盐酸做还原剂,氯气为氧化产物,据此进行分析;
(4)由题意确定A、B、C分别为Cl—、ClO—、ClO3—,根据转移电子守恒得离子方程式;根据反应热=反应物总键能-生成物总键能进行计算;根据反应电子转移情况进行相关计算。
(1)仪器F的名称是分液漏斗;组装好装置后首先要进行的操作是检查装置气密性,避免气体泄漏。
(2)E中尾气吸收:Cl2 + 2OH— = Cl— + ClO— + H2O。
(3)发生氧化反应的粒子是Cl-,所得产物就是氧化产物Cl2。
(4)由题意确定A、B、C分别为Cl—、ClO—、ClO3—,根据转移电子守恒得离子方程式: 3ClO—=2Cl—+ClO3—,反应热等于63KJ/mol+2×0KJ/mol—3×60KJ/mol=—117KJ/mol,该反应为放热反应;分析方程式:3mol ClO—转移4mol电子,消耗1.5mol ClO—,转移2mol电子。


科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在。Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr2O72-中元素铬(Cr)的化合价为_____。
(2)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入![]() 溶液直至过量,可观察到的现象是____。
溶液直至过量,可观察到的现象是____。
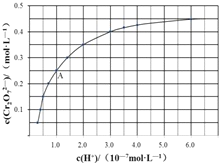
(3)CrO42-和Cr2O72-在溶液中可相互转化:2CrO42-+2H+![]() Cr2O72-+H2O,室温下,初始浓度为1.0molL-1的Na2CrO4溶液中,c(Cr2O72-)随c(H+)的变化如图所示。
Cr2O72-+H2O,室温下,初始浓度为1.0molL-1的Na2CrO4溶液中,c(Cr2O72-)随c(H+)的变化如图所示。
①溶液酸性增大,CrO42-的平衡转化率_________。(填“增大”“减小”或“不变”)。
②根据A点数据,计算出该转化反应的平衡常数为___________。
③温度升高,溶液中CrO42-的平衡转化率减小,则该反应的ΔH____0(填“>、=、<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实,不能用勒夏特列原理解释的是( )
A.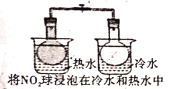 气体在热水中比在冷水中颜色深
气体在热水中比在冷水中颜色深
B.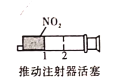 加压后气体颜色先变深后变浅
加压后气体颜色先变深后变浅
C.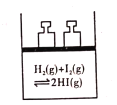 平衡体系加压后颜色变深
平衡体系加压后颜色变深
D.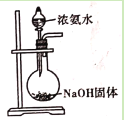 用浓氨水和NaOH固体制取氨气
用浓氨水和NaOH固体制取氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。某活动小组准备使用下列装置制备LiH固体。
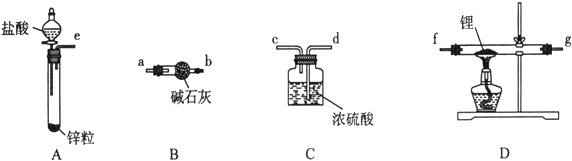
甲同学的实验方案如下:
(1)仪器的组装连接:上述仪器装置按气流从左到右连接顺序为________________,加入药品前首先要进行的实验操作是____________(不必写出具体的操作方法);其中装置B的作用是___________。
(2)添加药品:用镊子从试剂瓶中取出一定量金属锂(固体石蜡密封),然后在甲苯中浸洗数次,该操作的目的是____________________,然后快速把锂放入到石英管中。
(3)通入一段时间氢气后加热石英管,通氢气的作用是___________________________;在加热D处的石英管之前,必须进行的实验操作是__________。
(4)加热一段时间后,停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险,反应方程式为_____________。
(5)准确称量制得的产品0.174g,在一定条件下与足量水反应后,共收集到气体470.4 mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】描述 ![]() 分子结构的下列叙述中,正确的是
分子结构的下列叙述中,正确的是
A.6个碳原子有可能都在一条直线上B.6个碳原子一定都在同一平面上
C.6个碳原子不可能都在同一平面上D.所有原子有可能都在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质的溶液:①CH3COOH ②HCl ③ NaHSO4
(1)若将c(H+)均为0.1mol·L-1的三种溶液加水稀释100倍后,其中c(H+)最大的是________(用序号表示,下同)。
(2)若三种溶液的c(H+)均为0.1mol·L-1,分别向三种溶液中投入大小形状都相同的锌粒,一段时间后反应最快的是________________。
(3)若测定物质的量浓度相同的三种溶液的导电能力,小灯泡亮度最大的是_______________。
(4)若将6 g CH3COOH溶于水制成1L溶液,此溶液的物质的量浓度为________________,经测定溶液中c(CH3COO-)为1.4×10-3mol·L-1,此温度下醋酸的电离常数K=_____________,加入少量 NaHSO4固体后,K____________(填“变大”、“不变”或“变小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《hem Commun》报导,MarcelMayorl合成的桥连多环烃(![]() ),拓展了人工合成自然产物的技术。下列有关该烃的说法正确的是( )
),拓展了人工合成自然产物的技术。下列有关该烃的说法正确的是( )
A. 属于饱和烃,常温时为气态B. 二氯代物共有5种
C. 分子中含有4个五元环D. 不存在属于苯的同系物的同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B. CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C. 需要加热才能发生的反应一定是吸热反应
D. 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件。
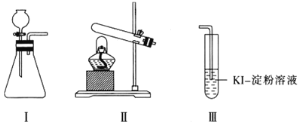
供选试剂:质量分数为30%的H2O2溶液、0.1 mol·L-1的H2SO4溶液、MnO2固体、KMnO4固体。
(1)小组同学设计甲、乙、丙三组实验,记录如下:
操作 | 现象 | |
甲 | 向装置I的锥形瓶中加入MnO2固体,向装置I的____中加入质量分数为30%的H2O2溶液,连接装置I、III,打开活塞 | 装置I中产生无色气体并伴随大量白雾;装置III中有气泡冒出,溶液迅速变蓝 |
乙 | 向装置II中加入KMnO4固体,连接装置II、III,点燃酒精灯 | 装置III中有气泡冒出,溶液不变蓝 |
丙 | 向装置II中加入____,向装置III中再加入适量0.1mol·L-1的H2SO4溶液,连接装置II、III,点燃酒精灯 | 装置III中有气泡冒出,溶液变蓝 |
(2)丙实验中O2与KI溶液反应的离子方程式为___________________________________。
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是__________。为进一步探究该条件对反应速率的影响,可采取的实验措施是____________________________。
(4)由甲、乙、丙三组实验推测,甲实验中可能是I中的白雾使溶液变蓝。为了验证推测,可将装置I中产生的气体通入_________(填字母)溶液中,依据实验现象来证明白雾中含有H2O2。
A.酸性KMnO4 B.FeCl2 C.H2S
(5)资料显示:KI溶液在空气中久置的过程中会被缓慢氧化:4KI+O2+2H2O=2I2+4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应___________________________________(写离子方程式)造成的,请设计实验证明他们的猜想是否正确:___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com