
【题目】四种短周期元素A、B、C、D的性质或结构信息如下:
信息:①原子半径:A<B<C<D。②四种元素之间形成的某三种分子的比例模型及部分性质如下:
物质 | 比例模型图 | 存在或性质 |
甲 |
| 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二 |
乙 |
| 无色,无气味并且易燃。是常见的一种基础能源 |
丙 |
| 有强氧化性的弱酸,有漂白性,可用于消毒杀菌 |
请根据上述信息回答下列问题。
(1)A的元素符号是__________;C元素在元素周期表中的位置是_______;甲的电子式是_______。
(2)丙可由D元素的单质与物质甲反应得到,该反应的离子方程式是________;D所在周期中,E元素的单质还原性最强,则E的单质与甲反应后的溶液呈_______(填“酸”或“碱”)性,用电离方程式表示其原因是___________________________。
(3)①A、B、C元素可组成多种化合物。由A、C组成的一种化合物丁,其产量常常用来衡量一个国家石油化工发展水平,则实验室中可用来除去乙中少量丁的试剂是_________。
②A、B、C组成的化合物中,有2种化合物的化学式均为C2A6B,则这2种化合物的关系互称为_________。为了鉴别这两种化合物,某同学用一小块E的单质分别投入盛有这2种化合物的试管中,其中与E的单质发生反应的化学方程式是_______________。
【答案】 H 第二周期第IVA族 ![]() Cl2+H2O=H++Cl-+HClO 碱 NaOH=Na++OH- ①Br2的CCl4溶液 同分异构体 2C2H5OH+2Na→2C2H5ONa+H2↑
Cl2+H2O=H++Cl-+HClO 碱 NaOH=Na++OH- ①Br2的CCl4溶液 同分异构体 2C2H5OH+2Na→2C2H5ONa+H2↑
【解析】四种短周期元素A、B、C、D,四种元素之间形成的某三种分子的比例模型及部分性质如下:甲:![]() 是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二,则甲是H2O;乙:
是地球上最常见的物质之一,是所有生命体生存的重要资源,约占人体体重的三分之二,则甲是H2O;乙:![]() 无色,无气味并且易燃,是常见的一种基础能源,则乙是
无色,无气味并且易燃,是常见的一种基础能源,则乙是![]() ;丙:
;丙:![]() 有强氧化性的弱酸,可以用于消毒杀菌,则丙是HClO,因为原子半径A>B>C>D,所以A、B、C、D分别是Cl>C>O>H。
有强氧化性的弱酸,可以用于消毒杀菌,则丙是HClO,因为原子半径A>B>C>D,所以A、B、C、D分别是Cl>C>O>H。
(1)由上述分析知Cl>C>O>H。,所以A是H元素。主族元素原子核外电子层数等于其周期数,最外层电子数等于其族序数,C是C元素,其原子核外有2个电子层、最外层电子数是4,所以位于第二周期第IVA族;因为甲是H2O,所以甲的电子式是![]() 。
。
(2)因为丙可为HClO是由D元素的单质为Cl2与物质甲是H2O反应得到,该反应的离子方程式是Cl2+H2O=H++Cl-+HClO;D为Cl所在周期是第三周期,与其同周期的E元素的单质还原性最强,则E为Na单质,钠与甲是H2O的反应后的溶液是NaOH溶液,呈碱性,用电离方程式表示其原因是:NaOH=Na++OH-。
(3)①A、B、C元素可组成多种化合物。由A、C组成的一种化合物丁,其产量常常用来衡量一个国家石油化工发展水平,则丁为乙烯,因乙为甲烷,实验室中可用来除去甲烷中少量乙烯的试剂是①Br2的CCl4溶液。
②A、B、C组成的化合物中有2种化合物,其结构简式分别为:CH3CH2OH和CH3OCH3,化学式均为C2H6O,则这2种化合物的关系互称为同分异构体。为了鉴别这两种化合物,某同学用一小块Na的单质分别投入盛有这2种化合物的试管中,其中能与Na的单质发生反应的化
学反应方程式为2C2H5OH+2Na→2C2H5ONa+H2↑。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】右图所示为锌铜原电池。下列叙述中,正确的是
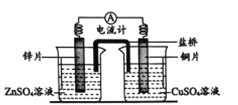
A. 盐桥的作用是传导离子
B. 外电路电子由铜片流向锌片
C. 锌片上的电极反应式为Zn2+ +2e- = Zn
D. 外电路中有0.2 mol 电子通过时,铜片表面增重约3.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
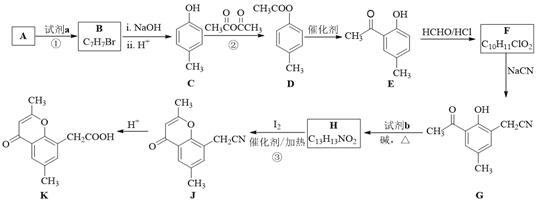
【题目】具有抗菌、消炎作用的黄酮醋酸类化合物L的合成路线如下图所示:
已知部分有机化合物转化的反应式如下:
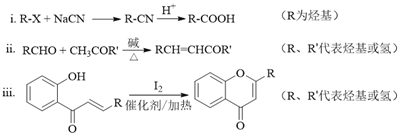
(1)A的分子式是C7H8,其结构简式是______;A→B所属的反应类型为______。
(2)C→D的化学方程式是______。
(3)写出满足下列条件的D的任意一种同分异构体的结构简式:______。
a.能发生银镜反应
b.分子中含有酯基
c. 苯环上有两个取代基,且苯环上的一氯代物有两种
(4)F的结构简式是______;试剂b是______。
(5)H与I2反应生成J和HI的化学方程式是______。
(6)以A和乙烯为起始原料,结合题中信息,选用必要的无机试剂合成苯乙酸乙酯(![]() ),参照下列模板写出相应的合成路线。_____________
),参照下列模板写出相应的合成路线。_____________
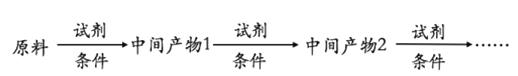
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究铝片做电极材料时的原电池反应,设计下表中装置进行实验并记录。
【实验1】
装置 | 实验现象 |
| 左侧装置电流计指针向右偏转,灯泡亮 右侧装置电流计指针向右偏转,镁条、铝条表面产生无色气泡 |
(1)实验1中,电解质溶液为盐酸,镁条做原电池的________极。
【实验2】
将实验1中的电解质溶液换为NaOH溶液进行实验2。
(2)该小组同学认为,此时原电池的总反应为2Al + 2NaOH + 2H2O ![]() 2NaAlO2 + 3H2↑,据此推测应该出现的实验现象为________。
2NaAlO2 + 3H2↑,据此推测应该出现的实验现象为________。
实验2实际获得的现象如下:
装置 | 实验现象 |
| i.电流计指针迅速向右偏转,镁条表面无气泡,铝条表面有气泡 ⅱ.电流计指针逐渐向零刻度恢复,经零刻度后继续向左偏转。镁条表面开始时无明显现象,一段时间后有少量气泡逸出,铝条表面持续有气泡逸出 |
(3)i中铝条表面放电的物质是溶解在溶液中的O2,则该电极反应式为________。
(4)ii中“电流计指针逐渐向零刻度恢复”的原因是________。
【实验3和实验4】
为了排除Mg条的干扰,同学们重新设计装置并进行实验3和实验4,获得的实验现象如下:
编号 | 装置 | 实验现象 |
实验3 |
| 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约10分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
实验4 |
煮沸冷却后的溶液 | 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约3分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
(5)根据实验3和实验4可获得的正确推论是________ (填字母序号)。
A. 上述两装置中,开始时铜片表面得电子的物质是O2
B. 铜片表面开始产生气泡的时间长短与溶液中溶解氧的多少有关
C. 铜片表面产生的气泡为H2
D. 由“铝条表面气泡略有减少”能推测H+在铜片表面得电子
(6)由实验1~实验4可推知,铝片做电极材料时的原电池反应与________等因素有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。
Ⅰ.已知:①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) ΔH=+93.0kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
③CH3OH(g)=CH3OH(l) ΔH=-38.19 kJ·mol-1
则表示CH3OH的燃烧热的热化学方程式为______________________________________________。
Ⅱ.在一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g),在2L恒容密闭容器中充入1mol CO和2molH2,在催化剂作用下充分反应。下图表示平衡混合物中CH3OH的体积分数在不同压强下随温度的变化的平衡曲线。回答下列问题:
CH3OH(g),在2L恒容密闭容器中充入1mol CO和2molH2,在催化剂作用下充分反应。下图表示平衡混合物中CH3OH的体积分数在不同压强下随温度的变化的平衡曲线。回答下列问题:
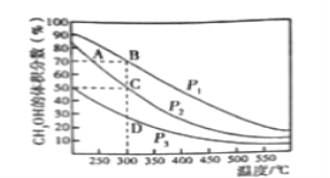
(1)该反应的反应热ΔH_______0(填“>”或“<”),压强的相对大小:p1_______p2(填“>”或“<”)。
(2)压强为p2,温度为300℃时,该反应的化学平衡常数K=________________。
(3)下列各项中,不能说明该反应已经达到平衡的是________________________________。
A.容器内气体压强不再变化 B.v(CO):c(H2):v(CO3OH)=1:2:1
C.容器内的密度不在变化 D.容器内混合气体的平均相对分子质量不再变化
E.容器内各组分的质量分数不再变化
(4)某温度下在保证H2浓度不变的情况下,增大容器的体积,平衡_________(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
作出此判断的依据是__________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示:锌与浓硫酸共热除生成二氧化硫气体外,还可能产生氢气;在加热的条件下二氧化硫可被CuO氧化。为验证该反应的气体产物及性质,设计了如下图所示的实验装置(设锌与浓硫酸共热时产生的气体为X)。

(1)上述装置的连接顺序为:气体X→A→____→A→ → → →D;
(2)反应开始后,观察到第一个装置A中的品红溶液褪色,实验结束后取适量该溶液于试管中并加热,现象为_______________________________________;
(3)装置 C中的NaOH溶液能用下列____代替;
a.酸性KMnO4溶液 b.CaCl2溶液 c.饱和NaHSO3溶液
装置D的作用是____________________________
(4)气体X中可能含有H2的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 向饱和NaCl溶液中1:1通入NH3和CO2制备NaHCO3
B. 500℃左右比通常状况下更有利于合成氨
C. 实验室中常用排饱和食盐水的方法收集氯气
D. 工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见物质,且均含有同一种元素,它们之间有如下转化,其中A是单质。
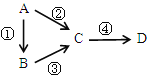
(1)若C是淡黄色固体常用于呼吸面具中的供氧剂,D是一种强碱。则C作供氧剂时与CO2反应的化学方程式为_______________________;其中还原剂是________,氧化产物是___________,7.8g C参加反应时转移的电子数是___________。
(2)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现。据此写出A元素的原子结构示意图是______。请写出A用于焊接铁轨的化学方程式___________________________。请写出②的离子方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种放射性核素,可治疗多种皮肤病。下列有关该核素说法正确的是
是一种放射性核素,可治疗多种皮肤病。下列有关该核素说法正确的是
A. ![]() 的摩尔质量是32
的摩尔质量是32
B. ![]() 和
和![]() 互称为同位素
互称为同位素
C. 1mol ![]() 含质子数约为32×6.02×1023
含质子数约为32×6.02×1023
D. 由质量数可以判断其在周期表的位置
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com