
| A. | CCl4可由CH4制得,可萃取碘水中的碘 | |
| B. | 乙醇与乙酸互为同分异构体 | |
| C. | 二氯甲烷只有一种结构 | |
| D. | 等物质的量的乙醇和乙烯完全燃烧时所需氧气的质量相等 |
分析 A、碘在四氯化碳中的溶解度比在水中的大,且四氯化碳不溶于水;
B、分子式相同而结构不同的化合物互为同分异构体;
C、甲烷为正四面体结构,4个H原子完全相同;
D、1mol乙醇和1mol乙烯燃烧均消耗3mol氧气.
解答 解:A、碘在四氯化碳中的溶解度比在水中的大,且四氯化碳不溶于水,且碘、水和四氯化碳三者间互不反应,故可以用四氯化碳来萃取碘水中的碘,故A正确;
B、分子式相同而结构不同的化合物互为同分异构体,而乙醇和乙酸的分子式不同,故不是同分异构体,故B错误;
C、甲烷为正四面体结构,4个H原子完全相同,故用两个-Cl取代两个-H原子,只有一种取代方式,故二氯甲烷的结构只有一种,故C正确;
D、1mol乙醇和1mol乙烯燃烧均消耗3mol氧气,故等物质的量的乙醇和乙烯燃烧时的耗氧量相同,故D正确.
故选B.
点评 本题考查了碘的萃取、同分异构体的判断和二氯代物结构的判断以及燃烧耗氧量的分析,难度不大,注意掌握基础.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 第一电离能 | 电负性 | 稳定性 | 酸性 |
| N>O | C<N | H2S<H2O | H2SO4<HClO4 |
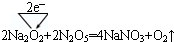 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SiO3$\stackrel{△}{→}$SiO2$\stackrel{HCl(aq)}{→}$SiCl4 | |
| B. | S$→_{催化剂/△}^{O_{2}}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| C. | Ca(ClO)2(aq)$\stackrel{CO_{2}}{→}$HClO(aq)$\stackrel{光照}{→}$HCl(aq) | |
| D. | Fe$→_{△}^{少量Cl_{2}}$FeCl2$\stackrel{NaOH溶液}{→}$Fe(OH)2$\stackrel{空气中放置}{→}$Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24b L | B. | $\frac{c-a}{71}$×22.4L | C. | $\frac{c-a}{17}$×22.4L | D. | $\frac{a-c}{35.5}$×22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 6.830 | 13.660 | 30.000 |
| 二氧化硫气体的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.800 | 1.600 | 3.200 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 右图是常见于汽车中的小摆件“苹果花”,它的动力是以Si为原料制作的太阳能电池 | |
| B. | 玻璃上的精美刻花,是工艺师用盐酸刻蚀玻璃形成的 | |
| C. | 互联网通过光纤交换信息,光纤的主要原料是SiO2 | |
| D. | 因为玻璃中含有SiO2,所以不能用磨口玻璃塞的试剂瓶盛装碱性溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com