
PM2. 5是指大气中直径小于或等于2.5微米的颗粒物,严重危害人体健康,也称为可入肺颗粒物。近年来我国PM2.5污染问题日益凸显。2013年长沙市开展PM2.5和臭氧监测,每天都公布空气质量级别。下面所列各项,在空气质量日报中完全正确的是( )
①可吸入颗粒物 ②总悬浮颗粒物 ③氢氧化物 ④二氧化碳 ⑤二氧化硫
⑥二氧化氮 ⑦一氧化碳 ⑧一氧化氮 ⑨氮气 ⑩臭氧
A.①③⑤⑦⑨ B.②③⑤⑥⑦ C.②④⑥⑦⑩ D.①⑤⑥⑦⑩
科目:高中化学 来源:2013-2014甘肃兰州一中高一下学期期末考试化学试卷(解析版) 题型:选择题
a mL三种气态烃组成的混合物与足量氧气混合,点燃爆炸后,恢复到原来的状态(常温、常压),体积共缩小2a mL。则三种烃可能是
A.CH4、C2H4、C3H4 B.C2H6、C3H6、C4H6
C.CH4、C2H6、C3H8 D.C2H4、C2H2、CH4
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省长沙市高三高考二模理综化学试卷(解析版) 题型:选择题
某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是
① pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
② 1 L 0.50 mol·L-1NH4Cl 溶液与2 L 0.25 mol·L-1NH4Cl 溶液含NH4+ 物质的量完全相等
③ pH相等的四种溶液:a.CH3COONa b.C6H5ONa c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a
④ pH=8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-)> c(H2CO3)
⑤ pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-) ≤ c(H+)
⑥ pH=4、浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
A.①②④B.①③⑤C.③⑤⑥D.②④⑥
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省衡南县高二下学期期末考试化学试卷(解析版) 题型:选择题
有①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液各25mL,物质的量浓度均为0.1mol/L,下列说法正确的是( )
A.三种溶液pH的大小顺序是③>②>①
B.若将三种溶液稀释相同倍数,pH变化最大的是②
C.若分别加入25mL 0.1mol/L盐酸后,pH最大的是①
D.若三种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省衡南县高二下学期期末考试化学试卷(解析版) 题型:选择题
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则( )
A.原子半径:丙<丁<乙
B.单质的还原性:丁>丙>甲
C.甲、乙、丙的氧化物均为共价化合物
D.乙、丙、丁的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省衡南县高一下学期期末考试化学试卷(解析版) 题型:选择题
(14分)原电池是化学对人类的一项重大贡献。(1)①某兴趣小组为研究原电池原理,设计如图装置。a和b不连接时,烧杯中发生反应的离子方程式是__________。
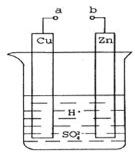
②a和b用导线连接,Cu极为原电池__________极(填“正”或“负”),电极反应式是__________。Zn极发生__________(填“氧化”或“还原”)反应。溶液中H+移向__________(填“Cu”或“Zn”)极。
③无论a和b是否连接,Zn片均被腐蚀。若转移了0.2mol电子,则理论上Zn片质量减轻了__________g。
(2)有同学想把Ba(OH)2?8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行?________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省衡南县高一下学期期末考试化学试卷(解析版) 题型:选择题
绿色化学提倡化工生产应提高原子利用率。原子利用率表示目标产物的质量与生成物总质量之比。在下列制备环氧乙烷( 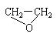 )的反应中,原子利用率最高的是( ).
)的反应中,原子利用率最高的是( ).

查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省益阳市高二上学期期末考试化学试卷(解析版) 题型:填空题
有A、B两种烃,其相关信息如下:
A | ①完全燃烧的产物中n(CO2):n(H2O)=2:1 ②28<M(A)<60 ③不能使溴的四氧化碳溶液褪色 ④一氯代物只有一种结构 |
B | ①饱和链烃,通常情况下呈气态 ②有同分异构体 ③二溴代物有三种 |
回答下列问题:
(1)烃A的实验式是 。
(2)烃A的化学式是 。
(3)烃B的二溴代物的结构简式为(写一种) 。
(4)每断开A中的1mol C—C键,并加成1 mol H2,吸收热量 a kJ,则1 mol A转化为B,需吸收的热量为 kJ。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
(14分)
含硫化合物在工业生产中有广泛的用途。
(1)对于可逆反应2SO2(g)+O2(g) 2SO3(g) △H<0,下列研究目的和图示相符的是
2SO3(g) △H<0,下列研究目的和图示相符的是
(填序号)
序号 | A | B | C | D |
目的 | 压强对平衡的影响 | 温度对转化率的影响 | 增加O2浓度对速率的影响 | 浓度对平衡常数的影响 |
图示 |
|
|
|
|
(2)在5000C有催化剂存在的条件下,向容积为2L的甲乙两个密闭容器中均充入2molSO2和1molO2。甲保持容积不变,乙保持压强不变,充分反应后,均达平衡状态,此时SO3的体积分数甲
乙。(填“>”“<”或“=” )
(3)向2L的甲容器中充入2molSO2、1molO2,测得SO2的平衡转化率与温度的关系如下图所示。
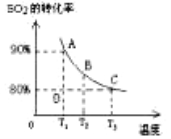
Ⅰ.在T1温度下,反应进行到状态D时,v正 v逆。(填“>”“<”或“=” )
Ⅱ.T3温度下,平衡时测得反应放出的热量为Q1,在相同温度下若再向容器中通入2molSO2、1molO2,重新达到平衡,测得反应又放出热量Q2 。则下列说法中正确的是 。(填序号)
A.相同温度下新平衡时容器中的压强是原平衡时的两倍
B.Q2一定大于Q1
C.新平衡时SO2的转化率一定大于80%
(4)在甲容器中充入一定量的SO2和1.100molO2,在催化剂作用下加热,当气体的物质的量减少0.315mol时反应达到平衡,此时测得气体压强为反应前的82.5%,则SO2的转化率为 。
(5)若用氢氧化钠溶液吸收SO2气体恰好得到酸式盐,已知该酸式盐溶液呈弱酸性,则溶液中各离子浓度由大到小的顺序为 。(用离子浓度符号表示)
(6)一定温度下,用水吸收SO2气体,若得到pH=5的H2SO3溶液,则溶液中亚硫酸氢根离子和亚硫酸根离子的物质的量浓度之比为 。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2mol/L,Ka2=6.0×10-3mol/L)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com