
分析 由步骤可知,碳酸钠水解显碱性,可促进油污的水解,加稀硫酸除去碳酸钠,且溶解Fe,过滤后,滤液中含Fe2+,与碳酸氢铵反应生成碳酸亚铁沉淀,经过过滤,洗涤,干燥,灼烧得到氧化铁;
(1)根据反应已经充分时反应停止即无现象发生判断;
(2)①Fe3C在足量的空气中高温煅烧,生成有磁性的固体X,X为Fe3O4,所以该反应方程式为:Fe3C+3O2$\frac{\underline{\;高温\;}}{\;}$Fe3O4+CO2,据此计算;
②X为Fe3O4,将X溶于稀硫酸反应生成硫酸亚铁、硫酸铁,据此书写离子方程式;
(3)步骤2滤液中含Fe2+,与碳酸氢铵反应生成碳酸亚铁沉淀,据此书写离子方程式;
(4)将步骤4经过过滤,洗涤,干燥,得到FeCO3固体;
(5)①根据以上分析煅烧后肯定生成氧化铁,要检验产品中是否存在FeO,则应先用酸将其溶解,再用酸性KMnO4溶液检验含有三价铁离子时是否含有二价铁离子;
②假设Fe2O3物质的量为x mol,FeO的物质的量为y mol,根据质量守恒和铁原子守恒列方程组计算.
解答 解:(1)因为反应已经充分时反应停止即无现象发生,所以当溶液中不再产生气泡时可以判断反应已经充分;故答案为:溶液中不再产生气泡;
(2)①Fe3C在足量的空气中高温煅烧,生成有磁性的固体X,X为Fe3O4,所以该反应方程式为:Fe3C+3O2$\frac{\underline{\;高温\;}}{\;}$Fe3O4+CO2,则煅烧时1mol W(Fe3C),消耗O2 3mol;故答案为:3;
②X为Fe3O4,将X溶于稀硫酸反应生成硫酸亚铁、硫酸铁,则离子方程式为 Fe3O4+8H+=2Fe3++Fe2++4H2O;故答案为:Fe3O4+8H+=2Fe3++Fe2++4H2O;
(3)步骤2滤液中含Fe2+,与碳酸氢铵反应生成碳酸亚铁沉淀,则生成FeCO3沉淀的化学方程式为FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O,故答案为:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O;
(4)将步骤4经过过滤,洗涤,干燥,得到FeCO3固体,故答案为:过滤;洗涤;干燥;
(5)①根据以上分析煅烧后肯定生成氧化铁,要检验产品中是否存在FeO,则应先用酸将其溶解,再用酸性KMnO4溶液检验含有三价铁离子时是否含有二价铁离子,又酸性KMnO4溶液会氧化氯离子,所以应选用硫酸溶解,所以这两种试剂是稀硫酸和酸性KMnO4溶液,故答案为:稀硫酸和酸性KMnO4溶液;
②假设Fe2O3物质的量为x mol,FeO的物质的量为y mol,那么满足:160x+72y=79200;铁原子守恒(2x+y)×116=116000,解得x=450mol,所以产物中Fe2O3的质量160g/mol×450mol=72000g=72kg,则该产品的纯度为$\frac{72}{79.2}$×100%=90.9%;故答案为:90.9%.
点评 本题考查元素化合物性质、基本操作与方案设计、常用化学用语等,关键是熟练综合应用相关元素化合物知识,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力,题目难度中等.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:实验题
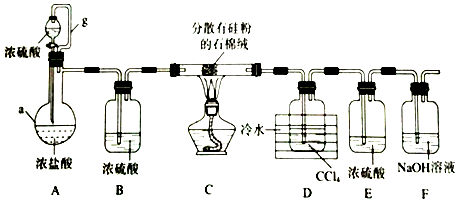
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ② | 2mL 0.1mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ③ | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液和少量MnSO4 |
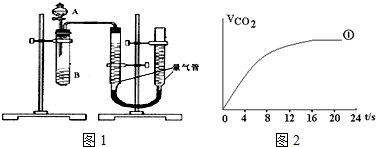
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | --- |
| 时间/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26.5 | 27 | 27 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
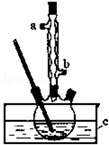 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:2C3CH2CH2CH2OH$→_{135°}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:2C3CH2CH2CH2OH$→_{135°}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
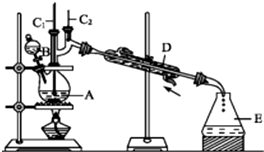 正丁醛是一种化工原料.
正丁醛是一种化工原料.| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变反应条件使平衡向正反应方向移动,反应物的转化率一定增大 | |
| B. | 浓度变化引起平衡向正反应方向移动,反应物的转化率一定增大 | |
| C. | 温度或压强的变化引起平衡向正反应方向移动,反应物的转化率一定增大 | |
| D. | 催化剂可使化学反应速率加快,使反应物的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
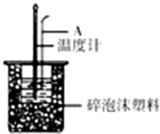 分别取40mL的0.50mol/L盐酸与40mL0.55mol/L氢氧化钠溶液进行中和热的测定.下列说法错误的是( )
分别取40mL的0.50mol/L盐酸与40mL0.55mol/L氢氧化钠溶液进行中和热的测定.下列说法错误的是( )| A. | 稍过量的氢氧化钠是确保盐酸完全反应 | |
| B. | 仪器A的名称是环形玻璃搅拌棒 | |
| C. | 在实验过程中,把温度计上的酸用水冲洗干净后再测量NaOH溶液的温度 | |
| D. | 用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,结果也是正确的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com