
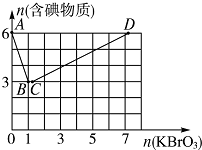
 现向含6molKI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.请回答下列问题:
现向含6molKI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.请回答下列问题:| 1 |
| 5 |
| 1 |
| 5 |
| 9 |
| 10 |
| 9 |
| 10 |


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
| A、能使湿润的蓝色石蕊试纸先变红后褪色 |
| B、使沾有酸性高锰酸钾溶液的滤纸褪色,证明了二氧化硫的漂白性 |
| C、使品红试纸褪色,证明了二氧化硫的漂白性 |
| D、沾有酚酞和NaOH 溶液的滤纸褪色,证明了二氧化硫具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 “氢能”将是未来最理想的新能源.
“氢能”将是未来最理想的新能源.查看答案和解析>>
科目:高中化学 来源: 题型:
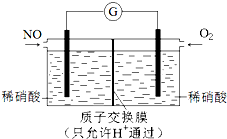 NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义.
NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义.| O3 |
| 反应I |
| CO(NH2)2 |
| 反应II |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、糖类、油脂、蛋白质都能发生水解反应 |
| B、油脂有油和脂肪之分,都属于酯类 |
| C、糖类、油脂、蛋白质都是由C、H、O三种元素组成的 |
| D、糖类、油脂、蛋白质都是高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com