
【题目】已知A,B,C,D,E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A,B,C是同一周期的非金属元素.化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为产生温室效应的主要气体.B,C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B,C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A,B,C,D,E用所对应的元素符号表示)
(1)A,B,C的第一电离能由小到大的顺序为 .
(2)B的氢化物分子的立体构型是 , 其中心原子采取杂化.
(3)写出化合物AC2的电子式;一种由B,C组成的化合物与AC2互为等电子体,其化学式为 .
(4)E的核外电子排布式是 , ECl3形成的配合物的化学式为 .
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 .
【答案】
(1)C<O<N
(2)三角锥形;sp3
(3)![]() ;N2O
;N2O
(4)1s22s22p63s23p63d54s1;[Cr(NH3)4(H2O)2]Cl3
(5)4Mg+10HNO3=4Mg(NO3)2+NH4NO3 +3H2O
【解析】解:化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构,说明D在C的下一周期,D应为Mg元素,C为O元素,AC2为产生温室效应的主要气体,应为CO2 , 则A为C元素,则B为N元素,E的原子序数为24,应为Cr元素,(1)同周期元素第一电离能从左到右有增大的趋势,故电离能大小为C<O<N,所以答案是:C<O<N;(2)B为N元素,对应的氢化物为NH3 , 分子中中心原子形成3个δ键且有1个孤电子对,为sp3杂化,空间构型为三角锥形,所以答案是:三角锥形;sp3;(3)AC2为CO2 , 为共价化合物,电子式为 ![]() ,一种由B、C组成的化合物与CO2互为等电子体,等电子体指电子数和原子数相同的分子、离子或基团,则该物质为N2O,所以答案是:
,一种由B、C组成的化合物与CO2互为等电子体,等电子体指电子数和原子数相同的分子、离子或基团,则该物质为N2O,所以答案是: ![]() ;N2O;(4)E为Cr元素,E的核外电子排布式是1s22s22p63s23p63d54s1 , 由ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界,可知该配合物为[Cr(NH3)4(H2O)2]Cl3 ,
;N2O;(4)E为Cr元素,E的核外电子排布式是1s22s22p63s23p63d54s1 , 由ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界,可知该配合物为[Cr(NH3)4(H2O)2]Cl3 ,
所以答案是:1s22s22p63s23p63d54s1;[Cr(NH3)4(H2O)2]Cl3;(5)N的最低价为﹣3,D为Mg元素,则应生成NH4NO3 , 反应的方程式为4Mg+10HNO3=4Mg(NO3)2+NH4NO3 +3H2O,
所以答案是:4Mg+10HNO3=4Mg(NO3)2+NH4NO3 +3H2O.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X等表示)原子半径的相对大小、最高正价或最低负价的变化如图1所示.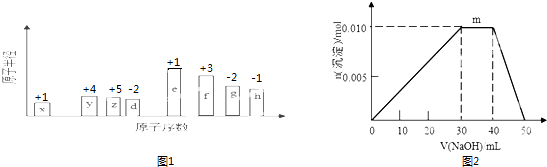
根据判断出的元素回答问题:
(1)z在元素周期表的位置是 .
(2)比较d、f简单离子的半径大小(用化学符号表示,下同)>;比较d、g元素的简单气态氢化物的稳定性大小> .
(3)任选上述元素组成一种四原子共价化合物,写出其电子式 .
(4)已知1mol固体e的单质在足量d2气体中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式 .
(5)由上述元素组成的离子化合物 Q:eh 和W:e2gd4 , 若电解含2molQ和2molW的混合水溶液,当阳极产生44.8L气体(标准状况下,且不考虑气体的溶解和损失)时,电路中转移电子的物质的量为mol.
(6)上述元素可组成盐R:zx4f(gd4)2 . 向盛有10mL1molL﹣1R溶液的烧杯中滴加1molL﹣1 NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如图2:①R溶液中,离子浓度由大到小的顺序是 .
②写出m点发生反应的离子方程式 .
③若在R溶液中改加20mL 1.2molL﹣1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁与水蒸气反应的实验装置如图,下列说法正确的是( )
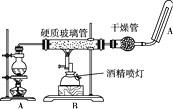
A. 实验时,先点燃酒精喷灯再点燃酒精灯
B. 干燥管中可盛装无水硫酸铜
C. 该反应中水做氧化剂
D. 反应的化学方程式为2Fe+3H2O(g) ![]() Fe2O3+3H2
Fe2O3+3H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E五种元素中,A原子3p轨道上成对电子数等于未成对电子数,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,C的价电子排布式为nsnnpn+2 , D的核电荷数是A与C的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:
(1)A的最高价氧化物的化学式为 , 中心原子的VSEPR构型为 .
(2)AC2与BC2分子的立体结构分别是和 , 相同条件下两者在水中的溶解度较大的是(写分子式),理由是 .
(3)D的元素符号是 , 它的核外电子排布式的简化式为 .
(4)用氢键表示写出E的氢化物的水溶液中存在的所有氢键 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配平下列化学方程式(其中(3)用双线桥标出转移的电子数
(1) Cu + HNO3(稀) — Cu(NO3)2 + NO↑ + H2O___________
(2) S+ NaOH— Na2S+ Na2SO3+ H2O_______________
(3) KClO3+ HCl— KCl+ Cl2↑+ H2O_____________
(4) Cr2O72-+ Fe2++ — Cr3++ Fe3++ ,_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医学上常用酸性高锰酸钾溶液和草酸溶液的反应来测定血钙的含量。回答下列问题:
H++ MnO4-+ H2C2O4— CO2↑+ Mn2++ ![]()
(1)配平以上离子方程式,并在![]() 中填上所需的微粒。_____________
中填上所需的微粒。_____________
(2)该反应中的还原剂是___________________。
(3)测定血钙的含量的方法:取2 mL血液用蒸馏水稀释后,向其中加入足量(NH4)2C2O4溶液,反应生成CaC2O4沉淀,将沉淀用稀硫酸溶解得到H2C2O4后,再用KMnO4溶液与其反应。
①稀硫酸溶解CaC2O4沉淀的化学方程式是________________________。
②溶解沉淀时____(“能”或“不能”)用稀盐酸,原因是________________。
③若消耗了1.0×10-4mol·L-1的KMnO4溶液20.00 mL,则100 mL该血液中含钙____mg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.6g烃A和Cl2发生取代反应,控制条件使其生成一氯代物,将反应生成的气体用NaOH溶液中和恰好和0.1molL﹣1NaOH溶液500mL完全反应,试解答下列问题:
(1)求链烃A的相对分子质量 .
(2)若A既不能使酸性KMnO4溶液褪色又不能使溴水褪色,试求该烃的分子式 , 并写出符合该分子式的所有可能的同分异构体的结构简式 .
(3)若A的一氯代物只有一种,试确定A的结构简式并用系统命名法命名、 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com