
| ʵ����� | Ԥ��Ŀ�� | |
| A | ����ͬ�¶��£��ֱ�ȡ�������Ĵ���ʯ�顢����ʯ��ĩ�ֱ���������Ũ�ȵ�ϡ���ᷴӦ | ̽����Ӧ��Ӵ�����Ի�ѧ��Ӧ���ʵ�Ӱ�� |
| B | ��ʢ����ɫ��ͬ��NO2��N2O4�Ļ���������֧�Թܣ��ܷ⣩�ֱ������ˮ����ˮ�� | ̽���¶ȶԻ�ѧƽ���Ӱ�� |
| C | ��������ʯī�õ������Ӻ���뺬��Fe2+��Cu2+������Һ�� | ̽��Fe2+��Cu2+�����������ǿ�� |
| D | ��ͬ�¶��£�����֧ʢ�е������Ũ��H2O2��Һ���Թ��зֱ����������CuSO4��Һ��FeCl3��Һ | ̽����ͬ������ͬһ��Ӧ���ʵ�Ӱ�� |
| A�� | A | B�� | B | C�� | C | D�� | D |
���� A��������ܣ�������̼��Ƶı��棬Ӱ��ʵ��Ч����
B����������Ϊ����ɫ���壬������ɫ�ı仯�������¶ȶ�ƽ���Ӱ�죻
C��ԭ����У�FeΪ����������Fe��Cu2+�ķ�Ӧ��
D��H2O2��Һ���Թ��зֱ����������CuSO4��Һ��FeCl3��Һ���ֽ����ʲ�ͬ��
��� �⣺A����������ܣ�������̼��Ƶı��棬Ӱ��ʵ��Ч��������̽���Ӵ�����Է�Ӧ���ʵ�Ӱ�죬����Ϊ������ʵ��ʵ��Ŀ�ģ���A����
B����������Ϊ����ɫ���壬������ɫ�ı仯�������¶ȶ�ƽ���Ӱ�죬���ʵ��̽���¶ȶԻ�ѧƽ���Ӱ�죬��B��ȷ��
C��ԭ����У�FeΪ����������Fe��Cu2+�ķ�Ӧ��˵��ͭ���ӵ������Դ����������ӵ������ԣ���C��ȷ��
D��H2O2��Һ���Թ��зֱ����������CuSO4��Һ��FeCl3��Һ���ֽ����ʲ�ͬ����̽����ͬ������ͬһ��Ӧ���ʵ�Ӱ�죬��D��ȷ��
��ѡA��
���� ���⿼��ʵ�鷽�������ۣ���Ŀ�ѶȲ�����ϤӰ�췴Ӧ���ʵ����ء�������ǿ���ıȽϡ���ѧƽ���Ӱ�����صȼ��ɽ������������ѧ���ķ�����������ѧʵ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
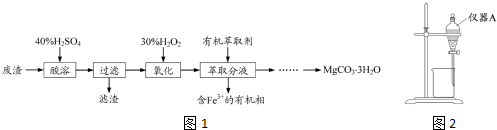
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1.2mol | B�� | 2mol | C�� | 0.8mol | D�� | 1.8mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ����ʵ | ���� |
| A | ����������ͬ��Na2S2O3��ҺŨ��Խ����ͬŨ�ȵ����ᷴӦ���������������ʱ��Խ�� | ��������������ʱ������Ӧ��Ũ�ȣ���ѧ��Ӧ�������� |
| B | ��ͭ���缫���CuSO4��Һ��CuSO4��ҺŨ�Ȳ��� | Cu2+û�в���缫��Ӧ |
| C | �ڳ�����N2������O2��Ӧ��������ȴ����ȼ | ��Ԫ�صķǽ����Ա���Ԫ�ص��� |
| D | ��������Ӧ | �������һ�����ܴ����ڼ�����Һ�� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 12��2.5 | B�� | 24��2.5 | C�� | 12��3 | D�� | 24��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| X | Y | ||
| Z | W |
| A�� | Ԫ�ص�����ϼ�Z����Y | |
| B�� | Ԫ�ص���̬�⻯����ȶ���Wǿ��Y | |
| C�� | ԭ�Ӱ뾶Z��YС | |
| D�� | Ԫ�ص�����������ˮ��������X����W |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ú��������ú����ҵ��ռ����Ҫ��λ��������Ȼ�ǻ�ѧ��ҵ����Ҫ��ɲ��֣�
ú��������ú����ҵ��ռ����Ҫ��λ��������Ȼ�ǻ�ѧ��ҵ����Ҫ��ɲ��֣�| �¶�/�� | 250 | 300 | 350 |
| K/L2•mol-2 | 2.041 | 0.270 | 0.012 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  | B�� |  | C�� |  | D�� |  |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com