
| A. | 1 mol物质在标准状况下的体积不一定为22.4 L | |
| B. | 1 mol任何气体在标准状况下的体积都约为22.4 L | |
| C. | 标准状况下,体积相同的气体分子数相等 | |
| D. | 气体摩尔体积约为22.4 L•mol-1 |
分析 A、气体摩尔体积指的是气体;
B、气体摩尔体积22.4L/mol适用于标况下的气体,1 mol任何气体在标准状况下的体积都约为22.4 L;
C、阿伏伽德罗定律可知,三同定一同分析;
D、气体摩尔体积与气体的存在条件有关,标准状况下气体摩尔体积Vm=22.4L/mol.
解答 解:A、1mol固体在标准状况下的体积不为22.4L,故A正确;
B、气体摩尔体积22.4L/mol适用于标况下的气体,标准状况下气体摩尔体积Vm=22.4L/mol,故B正确;
C、阿伏伽德罗定律可知,同温同压同体积的气体物质的量相同,分子数相同,故C正确;
D、气体摩尔体积与气体的存在条件有关,气体摩尔体积不一定为22.4 L•mol-1,标准状况下气体摩尔体积Vm=22.4L/mol,故D错误.
故选D.
点评 本题考查学生摩尔体积的概念,可以根据所学知识来回答,难度不大.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
 X、M、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能
X、M、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
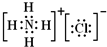 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NaOH+Cl2═NaCl+NaClO+H2O | B. | Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 | ||
| C. | 2FeCl3+Fe═3FeCl2 | D. | CaCO3 $\frac{\underline{\;高温\;}}{\;}$ CO2+CaO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活性炭使蓝色墨水褪色 | |
| B. | 盛石灰水的试剂瓶久置后内壁出现白色固体 | |
| C. | 蛋白质灼烧时发出烧焦羽毛的气味 | |
| D. | 湿润红布条置于氯气的集气瓶中,红布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐类发生水解的过程中,溶液的pH一定发生改变 | |
| B. | 向K2CO3溶液中通入CO2可使溶液中的c(CO32-)变大 | |
| C. | 向Na2SO3溶液中通入Cl2,溶液的导电性变强 | |
| D. | 一定温度下的密闭容器中,反应2NO2?N2O4达平衡时,再加入1molN2O4,平衡正向移动,且N2O4含量增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com