某硫酸厂进行硫铁矿(主要成分是FeS
2)含量的测定.取样品0.1000g在空气中充分灼烧,将生成的SO
2气体与足量的Fe
2(SO
4)
3溶液反应,反应后的溶液用浓度为0.02000mol?L
-1的KMnO
4溶液滴定至终点,消耗KMnO
4溶液30.00mL.已知:
SO
2+2Fe
3++2H
2O=SO
2-4+2Fe
2++4H
+;5Fe
2++MnO
-4+8H
+=5Fe
3++Mn
2++4H
2O
(1)滴定前
不需要
不需要
(填“需要”或“不需要”)滴加指示剂.滴定至终点的判断方法是
溶液变成紫红色且半分钟内不褪色
溶液变成紫红色且半分钟内不褪色
.
(2)样品中FeS
2的质量分数是
90%
90%
(假定杂质不参加反应).
(3)若灼烧6g纯净FeS
2产生的SO
2全部被氧化为SO
3气体,再将产生的SO
3气体全部与水化合生成硫酸溶液时,放出13.03kJ热量,写出SO
3气体转化为H
2SO
4溶液的热化学方程式:
SO3(g)+H2O(l)═H2SO4(aq)△H=-130.3KJ/mol
SO3(g)+H2O(l)═H2SO4(aq)△H=-130.3KJ/mol
.
(4)二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一.
①用CH
4催化还原NO
x为N
2可以消除氮氧化物的污染.试写出总反应的化学方程式:
xCH4+4NOx═2N2+xCO2+2H2O
xCH4+4NOx═2N2+xCO2+2H2O
.
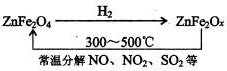
②新型纳米材料氧缺位铁酸锌(ZnFe
2O
x),常温下它能使工业废气中的氮的氧化物、SO
2分解,减小工业废气对环境的影响,它可由铁酸锌(ZnFe
2O
4)经高温还原制得.转化流程如下图所示:
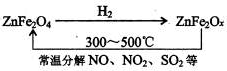
若2mol ZnFe
2O
x与SO
2反应可生成0.75mol S,则x=
3.25
3.25
.




 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案