


科目:高中化学 来源: 题型:
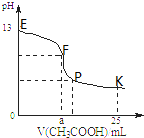 25℃时,在25mL0.1mol/L的NaOH溶液中逐渐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论不正确的是( )
25℃时,在25mL0.1mol/L的NaOH溶液中逐渐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论不正确的是( )| A、a=12.5,且混合溶液pH=7 |
| B、对应曲线上E、F间任何一点,溶液中都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| C、P点时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D、K点时,c(CH3COO-)+c(CH3COOH)=2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| n(CH3OH) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、通惰性气体增大压强,平衡正向移动 | ||
| B、再加入X,反应吸收的热量增大 | ||
| C、增加Y的物质的量,X的转化率减小 | ||
D、降低温度,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、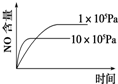 |
C、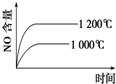 |
D、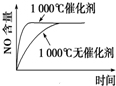 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+4 | B、+5 | C、+6 | D、+7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com