
下列关于药品的使用和保存,仪器选用正确的是
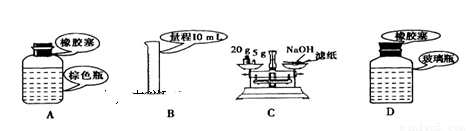
A.实验室中保存浓硝酸 B.准确量取9.50 mL稀硫酸
C.用托盘天平称量NaOH固体 D.实验室中保存Na2CO3溶液
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年山东省淄博市高二上第一次阶段测化学试卷(解析版) 题型:选择题
热化学方程式S(l)+O2(g)===SO2(g);ΔH=-293.23 kJ/mol.分析下列说法中不正确的是
A. S(s)+O2(g)===SO2(g),生成1mol SO2(g), 反应放出的热量小于293.23 kJ
B.S(g)+O2(g)===SO2(g),生成1mol SO2(g), 反应放出的热量大于293.23 kJ
C.1 mol SO2的键能的总和大于1 mol 硫和1 mol 氧气的键能之和
D.1 mol SO2的键能的总和小于1 mol 硫和1 mol 氧气的键能之和
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省金兰教育合作组织高一上学期期中联考化学试卷(解析版) 题型:选择题
对于某些离子的检验及结论一定正确的是
A.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42﹣
B.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32﹣
C.无色溶液焰色反应呈黄色,结论:试液是钠盐溶液
D.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
查看答案和解析>>
科目:高中化学 来源:2016届广东省惠州市高三上学期第二次调研测试化学试卷(解析版) 题型:选择题
常温下,有下列四种溶液:
① | ② | ③ | ④ |
0.1mol/L NaOH溶液 | pH = 11 NaOH溶液 | 0.1mol/L CH3COOH溶液 | pH = 3 CH3COOH溶液 |
下列说法正确的是
A.由水电离出H+的浓度c(H+) :①>③
B.将④加蒸馏水稀释至原来的100倍时,所得溶液的pH=5
C.①与③混合,若溶液pH = 7,则体积V(NaOH)>V(CH3COOH)
D.将②与④等体积混合,若溶液pH < 7,各离子浓度的关系为:c(CH3COO-) + c(OH-) = c(Na+) +c(H+)
查看答案和解析>>
科目:高中化学 来源:2016届广西省钦州市钦南区高三上学期期中质量调研测试化学试卷(解析版) 题型:填空题
过氧化钠、过氧化镁、过氧化氢都是重要的过氧化物。回答下列问题:
(1)过氧化镁不溶于水,但易溶于稀酸。广泛用作胃药,治疗胃酸过多。试写出过氧化镁与胃酸反应的离子方程式: 。
(2)高温下,过氧化钠在隔绝空气环境中可以将铁单质氧化成含FeO42— 高铁酸盐,该反应的化学方程式为 。
(3)取少量含Fe2+、H+ 溶液于试管中,滴加几滴硫氰酸钾溶液,无明显现象;再滴加H2O2,发现溶液变红色,其中包括的反应有 (写离子方程式);继续加H2O2,红色逐渐褪去且有气泡产生,反应原理为:H2O2 +SCN— →SO42- + CO2↑+ N2↑ + H2O +
(SCN— 中S为—2价,将方程式补充完成并配平)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上学期第三次月考化学试卷(解析版) 题型:选择题
将0.2 mol·L-1 HCOOH溶液加水稀释,下列说法正确的是( )
A.溶液中c(H+)和c(OH-)都减小 B.溶液中c(H+)增大
C.醋酸电离平衡向左移动 D.溶液的pH增大
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中考试化学试卷(解析版) 题型:选择题
一定条件下,中学化学常见物质甲、乙存在转化关系,则乙可能是( )

A.Al(OH)3 B.H2SiO3 C.FeCl2 D.CH3C1
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上学期第二次模拟化学试卷(解析版) 题型:选择题
有A、B、C、D四种短周期元素在周期表中位置如图所示。已知:A2+与C原子的电子数相差2。下列推断不正确的是
…… | C | |||
A | B | …… | D |
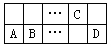
A.A和D组成的化合物是弱电解质且水溶液呈酸性
B.与A同周期且与C同主族的E元素,其最高价氧化物对应水化物在某些化学反应中常作催化剂
C.离子半径:C>A>B
D.B与C形成的化合物是冶金工业的一种原料
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三上学期12月月考理综化学试卷(解析版) 题型:填空题
Ⅰ.(1)工业上合成氨的反应:N2(g)+3H2(g) 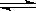 2NH3(g) ΔH=-92.60 kJ·mol-1。
2NH3(g) ΔH=-92.60 kJ·mol-1。
①恒温容积固定的密闭容器中发生反应:N2(g)+3H2(g) 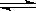 2NH3(g),下列说法能说明上述反应达到平衡状态的是____________。
2NH3(g),下列说法能说明上述反应达到平衡状态的是____________。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量不变
e.容器内的气体密度不变
f.容器内气体的压强不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
Ⅱ.(1)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径。目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g) 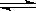 CH3OCH3(g)+3H2O(g) ΔH>0。二甲醚气体的燃烧热为1 455 kJ·mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚。下列有关叙述正确的是________。
CH3OCH3(g)+3H2O(g) ΔH>0。二甲醚气体的燃烧热为1 455 kJ·mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚。下列有关叙述正确的是________。
A.二甲醚分子中含极性共价键
B.二甲醚作为汽车燃料不会产生污染物
C.二甲醚是非极性分子 D.表示二甲醚燃烧热的热化学方程式为CH3OCH3(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 455 kJ·mol-1
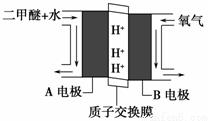
(2)绿色电源“直接二甲醚燃料电池”的工作原理示意图如图所示:正极为________(填“A电极”或“B电极”),H+移动方向为:由 到 (填A或B),写出A电极的电极反应式:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com