
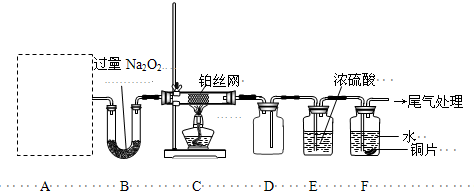
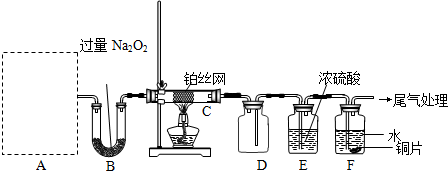
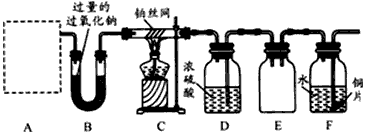
 科研小组为探究氮的化合物性质,按如图连接好装置,进行实验.将C处Pt丝加热至红热,再将A试管中物质加热,片刻撤去C处酒精灯.部分实验现象有:①Pt丝继续保持红热,②E中Cu片慢慢溶解.回答下列问题:
科研小组为探究氮的化合物性质,按如图连接好装置,进行实验.将C处Pt丝加热至红热,再将A试管中物质加热,片刻撤去C处酒精灯.部分实验现象有:①Pt丝继续保持红热,②E中Cu片慢慢溶解.回答下列问题:
| ||
| △ |
| ||
| △ |
| ||
| △ |
| ||
| △ |


科目:高中化学 来源: 题型:阅读理解
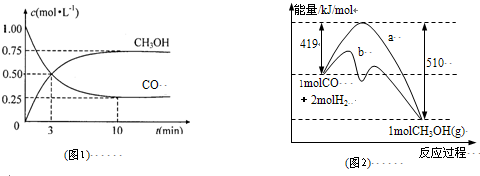
| c(CH3OH) |
| c(CO)×c2(H2) |
| c(CH3OH) |
| c(CO)×c2(H2) |
| n(CH3OH) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学课外活动小组为探究氮的化合物的性质,设计了如下图所示实验。A处是气体发生装置,A中所用实验药品从下列物质中选取:
①Na2CO3 ②NaHCO3 ③NH4HCO3 ④NH4Cl ⑤Ca(OH)2 ⑥浓氨水 ⑦NaOH
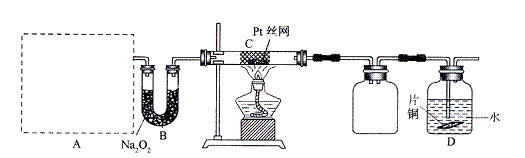
按上图连接好各仪器,先将C处Pt丝网加热至红热,再将A处产生的气体通过B装置片刻后撤去C处酒精灯。部分实验现象如下:Pt丝继续保持红热,D中Cu片慢慢溶解。
回答下列问题:
(1)若A中制取气体时只用一种药品,该药品为 (填前述备选药品的序号),则制取气体所用到的玻璃仪器有 。
(2)B装置的作用为 。
(3)写出C中发生反应的化学方程式 。
(4)D中Cu片发生反应的离子方程式为 。为了使Cu片溶解的速度明显加快,可向D处的溶液中加入下列物质中的 (填下列各项序号)。
a.Na2CO3 b.AgNO3 c.CuSO4 d.FeSO4
(5)有人认为他们设计的这套实验装置还存在明显的不足,对其不足之处以及应如何改进谈谈你的意见: 。
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com